题目内容
3.某实验小组同学设计实验,完成了Cu和FeCl3溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究.实验I: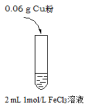 | 实验现象 |
| i.加入Cu粉后充分振荡,溶液变成浅蓝绿色; ii.取少量i中清液于试管中,滴加2滴1 mol/L KSCN溶液,立即出现白色沉淀,溶液变为红色,振荡后红色迅速褪去;继续滴加KSCN数滴溶液后,溶液又变为红色 |
ii.(SCn)2的性质与卤素单质相似,且氧化性:Br2>(SCN)2>I2
(1)Cu和FeCl3溶液反应的离子方程式是2Fe 3++Cu=2Fe 2++Cu 2+.
(2)现象ii中溶液最终呈红色的一种可能原因是:Cu2+和SCN-生成(SCN)2,进而使清液中的Fe2+氧化为Fe3+.设计了如图1所示的实验II进行验证:
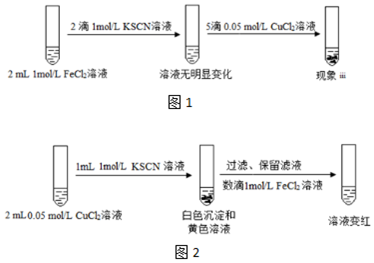
①认为原因被证实的现象iii是出现白色沉淀,溶液显红色.
②加入CuCl2溶液后反应的离子方程式是2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3.
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如图2所示:
①对比实验II,说明实验III更加严谨的原因:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+.
②改进后的实验才能证实(2)中猜想,依据的上述现象是加入KSCN之后溶液变黄,加入FeCl2之后变红.
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
| 实验IV | 现象 |
| 向2mL 1mol/LFeCl3溶液中加入1滴1mol/L KSCN溶液,再加入足量的Cu粉 | 充分振荡,溶液红色褪去,有白色沉淀生成 |
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有Fe3+的是abc(填序号).
a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测
b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测
c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象
d.加入足量铁粉,再向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液进行检测.
分析 (1)FeCl3具有氧化性,能氧化Cu生成氯化铜,同时自身被还原生成氯化亚铁;
(2)①根据Cu2+和SCN-生成(SCN)2和CuSCN,进而(SCN)2使清液中的Fe2+氧化为Fe3+,再与SCN-生成Fe(SCN)3;
②加入CuCl2溶液后反应的离子方程式是:2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3或Cu2++4SCN-+Fe 2+=CuSCN↓+Fe(SCN)3;
(3)①CuCl2溶液有颜色影响Fe(SCN)3溶液颜色的判断;
②在没用Cu2+而有SCN-和(SCN)2的溶液中滴加FeCl2溶液的现象:加入KSCN之后溶液变黄,加入FeCl2之后变红;
(4)①Cu只要和Fe3+反应生成Cu2+和Fe2+,它们就会与SCN-反应,故红色褪去也有可能是溶液中的SCN-被消耗完;
②检测红色褪去后的溶液是否含有Fe3+的方法有:a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测;b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测;c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象.
解答 解:(1)FeCl3具有氧化性,能氧化Cu生成氯化铜,同时自身被还原生成氯化亚铁,离子方程式为2Fe 3++Cu=2Fe 2++Cu 2+,
故答案为:2Fe 3++Cu=2Fe 2++Cu 2+;
(2)①根据Cu2+和SCN-生成(SCN)2和CuSCN,进而(SCN)2使清液中的Fe2+氧化为Fe3+,再与SCN-生成Fe(SCN)3,由此推知现象为:出现白色沉淀,溶液显红色.
故答案为:出现白色沉淀,溶液显红色;
②加入CuCl2溶液后反应的离子方程式是:2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3或Cu2++4SCN-+Fe 2+=CuSCN↓+Fe(SCN)3,
故答案为:2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3或Cu2++4SCN-+Fe 2+=CuSCN↓+Fe(SCN)3;
(3)①CuCl2溶液有颜色影响Fe(SCN)3溶液颜色的判断.由于KSCN溶液过量,所以黄色溶液中不含有Cu2+,
故答案为:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+;
②在没用Cu2+而有SCN-和(SCN)2的溶液中滴加FeCl2溶液的现象:加入KSCN之后溶液变黄,加入FeCl2之后变红;
故答案为:加入KSCN之后溶液变黄,加入FeCl2之后变红;
(4)①Cu只要和Fe3+反应生成Cu2+和Fe2+,它们就会与SCN-反应,故红色褪去也有可能是溶液中的SCN-被消耗完,
故答案为:因为Cu只要和Fe3+反应生成Cu2+和Fe2+,它们就会与SCN-反应,所以红色褪去也有可能是溶液中的SCN-被消耗完;
②检测红色褪去后的溶液是否含有Fe3+的方法有:a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测;b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测;c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象.而加入足量铁粉,向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液,是检测Fe2+的,故d选项错误.
故答案为:abc
点评 本题综合考查物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握题给信息以及实验的原理、方法,为解答该题的关键,答题时注意审题,难度较大.

| A. | 标准状况下,2.24 L水中含有分子数目为0.1NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA | |
| D. | 常温下,2 L 0.1 mol•L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA |
| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度为1 mol•L-1 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分溶解后就可配得该浓度的硫酸溶液 | |
| D. | 已知该硫酸为稀硫酸,稀硫酸具有酸的通性,可与锌反应制取氢气 |
| A. | 向Fe(OH)3胶体中加入4 mol/LH2SO4至过量 | |
| B. | 向紫色石蕊试剂中通入过量C12 | |
| C. | 向紫色石蕊试剂中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
| A. | C4H10和C20H42 | B. | 一溴乙烷和1,2-二溴乙烷 | ||
| C. | 邻二甲苯和对二甲苯 | D. | C4H8和C3H6 |
①塑料 ②合成氨 ③合成盐酸 ④合成橡胶 ⑤合成纤维 ⑥合成尿素 ⑦合成洗涤剂.
| A. | ②④⑦ | B. | ①②⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
| A. | 辛烯和3-甲基-1-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 软脂酸和硬脂酸 |
| 选项 | 待提纯的物质 | 选用的试剂 | 主要操作方法 |
| A | 乙醇(水) | 加热蒸发 | |
| B | NaCl溶液(MgCl2) | Ba(OH)2溶液 | 过滤 |
| C | 四氯化碳(碘) | 过滤 | |
| D | CO(CO2) | NaOH溶液,浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |