题目内容
18.下列各组物质中,相互间一定互为同系物的是( )| A. | C4H10和C20H42 | B. | 一溴乙烷和1,2-二溴乙烷 | ||
| C. | 邻二甲苯和对二甲苯 | D. | C4H8和C3H6 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.互为同系物的物质具有以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同.
解答 解:A.C4H10和C20H42属于烷烃,相差若干个CH2原子团,是同系物,故A符合;
B.一溴乙烷和1,2-二溴乙烷,含有Br原子数目不同,即分子组成通式不同,不是同系物,故B不符合;
C.邻二甲苯和对二甲苯分子式相同,结构不同,互为同分异构体,不是同系物,故C不符合;
D.C4H8和C3H6,如果都含有一个C=C,则结构相似,组成通式相同,相差一个CH2原子团,二者互为同系物,如果一个含有C=C,另一个含有碳环,则结构不同,不是同系物,故D不符合.
故选A.
点评 本题考查同系物的概念与判断,难度不大,注意把握概念的内涵与外延,含有官能团的有机物官能团必须相同.

练习册系列答案
相关题目
8.下列物质分类正确的是( )
| A. | SO2、SiO2、CO、P2O5均为酸性氧化物 | |
| B. | 有色玻璃、稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 空气、福尔马林、水玻璃、氨水均为混合物 | |
| D. | 烧碱、冰醋酸、四氯化碳、石墨均为电解质 |
9.下列关于电解法精炼粗铜的叙述中不正确的是( )
| A. | 粗铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液 | |
| B. | 电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
6.有关实验操作,下列说法中正确的是( )
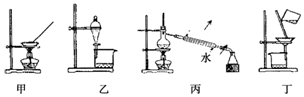

| A. | 甲装置可用于灼烧胆矾,制备无水硫酸铜 | |
| B. | 乙装置可用于分离溴单质与四氯化碳 | |
| C. | 丙装置可用于蒸馏,分离乙醇和水 | |
| D. | 丁装置可用于过滤,分离汽油和水的混合物 |
13.常温下,对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
| A. | 水电离出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分别稀释100倍后的pH④<③ |
3.某实验小组同学设计实验,完成了Cu和FeCl3溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究.
已知:i.Cu2+$\stackrel{SCN-}{→}$CuSCN↓(白色)+(SCn)2(黄色)
ii.(SCn)2的性质与卤素单质相似,且氧化性:Br2>(SCN)2>I2
(1)Cu和FeCl3溶液反应的离子方程式是2Fe 3++Cu=2Fe 2++Cu 2+.
(2)现象ii中溶液最终呈红色的一种可能原因是:Cu2+和SCN-生成(SCN)2,进而使清液中的Fe2+氧化为Fe3+.设计了如图1所示的实验II进行验证:
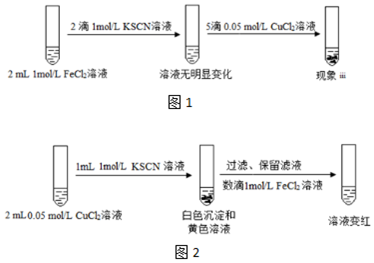
①认为原因被证实的现象iii是出现白色沉淀,溶液显红色.
②加入CuCl2溶液后反应的离子方程式是2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3.
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如图2所示:
①对比实验II,说明实验III更加严谨的原因:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+.
②改进后的实验才能证实(2)中猜想,依据的上述现象是加入KSCN之后溶液变黄,加入FeCl2之后变红.
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
①实验IV中溶液红色褪去,不能说明Fe3+反应完全.结合实验II或III,说明理由:因为Cu只要和Fe3+反应生成Cu2+和Fe2+,它们就会与SCN-反应,所以红色褪去也有可能是溶液中的SCN-被消耗完.
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有Fe3+的是abc(填序号).
a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测
b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测
c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象
d.加入足量铁粉,再向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液进行检测.
实验I: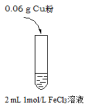 | 实验现象 |
| i.加入Cu粉后充分振荡,溶液变成浅蓝绿色; ii.取少量i中清液于试管中,滴加2滴1 mol/L KSCN溶液,立即出现白色沉淀,溶液变为红色,振荡后红色迅速褪去;继续滴加KSCN数滴溶液后,溶液又变为红色 |
ii.(SCn)2的性质与卤素单质相似,且氧化性:Br2>(SCN)2>I2
(1)Cu和FeCl3溶液反应的离子方程式是2Fe 3++Cu=2Fe 2++Cu 2+.
(2)现象ii中溶液最终呈红色的一种可能原因是:Cu2+和SCN-生成(SCN)2,进而使清液中的Fe2+氧化为Fe3+.设计了如图1所示的实验II进行验证:

①认为原因被证实的现象iii是出现白色沉淀,溶液显红色.
②加入CuCl2溶液后反应的离子方程式是2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3.
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如图2所示:
①对比实验II,说明实验III更加严谨的原因:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+.
②改进后的实验才能证实(2)中猜想,依据的上述现象是加入KSCN之后溶液变黄,加入FeCl2之后变红.
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
| 实验IV | 现象 |
| 向2mL 1mol/LFeCl3溶液中加入1滴1mol/L KSCN溶液,再加入足量的Cu粉 | 充分振荡,溶液红色褪去,有白色沉淀生成 |
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有Fe3+的是abc(填序号).
a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测
b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测
c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象
d.加入足量铁粉,再向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液进行检测.
10.食品的主要成分大都是有机化合物.下列食品中的有机成分不属于高分子化合物的是( )
| A. | 肥肉中的油脂 | B. | 谷类中的淀粉 | C. | 蔬菜中的纤维素 | D. | 瘦肉中的蛋白质 |
7.已知NH4CuSO3与足量的3mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色.据此判断下列说法错误的是( )
| A. | NH4CuSO3中只有Cu元素被氧化 | |
| B. | 反应中硫酸作氧化剂 | |
| C. | 刺激性气味的气体是二氧化硫 | |
| D. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 |
8.下列离子方程式正确的是( )
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量的金属铜加入到FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 将少量NaOH溶液与足量Ba(HCO3)2溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |