题目内容
13.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,2.24 L水中含有分子数目为0.1NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA | |
| D. | 常温下,2 L 0.1 mol•L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA |
分析 A.标准状况下,水的状态不是气态;
B.氧气和臭氧都是由O元素组成,根据n=$\frac{m}{M}$计算混合物中含有氧原子的物质的量及数目;
C.5.6g铁的物质的量为0.1mol,若反应生成硝酸亚铁,则转移电子的物质的量为0.2mol;
D.碳酸钠溶液中,碳酸根离子部分水解,导致碳酸根离子的数目减少.
解答 解:A.标况下水不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.6.4g二者混合物中含有6.4gO原子,含有氧原子的物质的量为:$\frac{6.4g}{16g/mol}$=0.4mol,含有的原子总数为0.4NA,故B正确;
C.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,若反应生成硝酸亚铁,则反应失去0.2mol电子,转移电子的物质的量为0.2mol,转移的电子数目一定为0.2NA,故C错误;
D.2 L 0.1mol•L-1Na2CO3溶液中含有0.2mol碳酸钠,由于碳酸根离子发生水解,则溶液中含有碳酸根离子的物质的量小于0.2mol,含有的CO32-离子数小于0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确标况下气体摩尔体积的使用条件为解答结构,注意掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题有利于提高学生的化学计算能力.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
9.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
其中正确的操作顺序是( )
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
其中正确的操作顺序是( )
| A. | ②⑤④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ⑤②①④③ |
10. 如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
 如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )| A. | 电源B极是负极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1~2~2~2√ | |
| C. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
8.下列物质分类正确的是( )
| A. | SO2、SiO2、CO、P2O5均为酸性氧化物 | |
| B. | 有色玻璃、稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 空气、福尔马林、水玻璃、氨水均为混合物 | |
| D. | 烧碱、冰醋酸、四氯化碳、石墨均为电解质 |
18.下列说法错误的是( )
| A. | 58.5g NaCl溶于1L水中配得1mol/L NaCl溶液 | |
| B. | 在标准状况下,44.8LHCl气体溶于水配成1L溶液,所得溶液中溶质的物质的量浓度为2mol/L | |
| C. | 在标准状况下,22.4L氨气溶于水配成1L溶液,从所得溶液中取出10mL,其物质的量浓度为1mol/L | |
| D. | 1mol/L的CaCl2溶液1L,取出100mL,含0.2molCl- |
5.用98%的浓硫酸(ρ=1.84g•mL-1)配制1mol•L-1的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
①玻璃棒②胶头滴管 ③100mL容量瓶④托盘天平⑤50mL烧杯⑥10mL量筒 ⑦100mL量筒.
①玻璃棒②胶头滴管 ③100mL容量瓶④托盘天平⑤50mL烧杯⑥10mL量筒 ⑦100mL量筒.
| A. | ⑥⑤③②① | B. | ⑦⑤③①② | C. | ④⑤③②①⑨ | D. | ⑥⑤①③② |
2.下列关于钠的说法不正确的是( )
| A. | 金属钠与O2反应,条件不同,产物不同 | |
| B. | 少量钠可保存在煤油中 | |
| C. | 金属钠质软,可以用小刀切割 | |
| D. | 由于钠很活泼,所以它能从水溶液中置换出金属活动性顺序表中排在钠后面的金属 |
3.某实验小组同学设计实验,完成了Cu和FeCl3溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究.
已知:i.Cu2+$\stackrel{SCN-}{→}$CuSCN↓(白色)+(SCn)2(黄色)
ii.(SCn)2的性质与卤素单质相似,且氧化性:Br2>(SCN)2>I2
(1)Cu和FeCl3溶液反应的离子方程式是2Fe 3++Cu=2Fe 2++Cu 2+.
(2)现象ii中溶液最终呈红色的一种可能原因是:Cu2+和SCN-生成(SCN)2,进而使清液中的Fe2+氧化为Fe3+.设计了如图1所示的实验II进行验证:
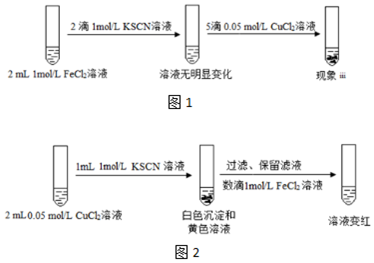
①认为原因被证实的现象iii是出现白色沉淀,溶液显红色.
②加入CuCl2溶液后反应的离子方程式是2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3.
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如图2所示:
①对比实验II,说明实验III更加严谨的原因:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+.
②改进后的实验才能证实(2)中猜想,依据的上述现象是加入KSCN之后溶液变黄,加入FeCl2之后变红.
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
①实验IV中溶液红色褪去,不能说明Fe3+反应完全.结合实验II或III,说明理由:因为Cu只要和Fe3+反应生成Cu2+和Fe2+,它们就会与SCN-反应,所以红色褪去也有可能是溶液中的SCN-被消耗完.
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有Fe3+的是abc(填序号).
a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测
b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测
c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象
d.加入足量铁粉,再向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液进行检测.
实验I: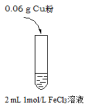 | 实验现象 |
| i.加入Cu粉后充分振荡,溶液变成浅蓝绿色; ii.取少量i中清液于试管中,滴加2滴1 mol/L KSCN溶液,立即出现白色沉淀,溶液变为红色,振荡后红色迅速褪去;继续滴加KSCN数滴溶液后,溶液又变为红色 |
ii.(SCn)2的性质与卤素单质相似,且氧化性:Br2>(SCN)2>I2
(1)Cu和FeCl3溶液反应的离子方程式是2Fe 3++Cu=2Fe 2++Cu 2+.
(2)现象ii中溶液最终呈红色的一种可能原因是:Cu2+和SCN-生成(SCN)2,进而使清液中的Fe2+氧化为Fe3+.设计了如图1所示的实验II进行验证:

①认为原因被证实的现象iii是出现白色沉淀,溶液显红色.
②加入CuCl2溶液后反应的离子方程式是2Cu2++4SCN-=2CuSCN↓+(SCN)2、2Fe 2++(SCN)2+4SCN-=2Fe(SCN)3.
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如图2所示:
①对比实验II,说明实验III更加严谨的原因:由于KSCN溶液过量,所以黄色溶液中不含有Cu2+.
②改进后的实验才能证实(2)中猜想,依据的上述现象是加入KSCN之后溶液变黄,加入FeCl2之后变红.
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
| 实验IV | 现象 |
| 向2mL 1mol/LFeCl3溶液中加入1滴1mol/L KSCN溶液,再加入足量的Cu粉 | 充分振荡,溶液红色褪去,有白色沉淀生成 |
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有Fe3+的是abc(填序号).
a.排除溶液中的Fe2+后,再加入足量KSCN溶液进行检测
b.排除溶液中的Cu2+后,再加入足量KSCN溶液进行检测
c.选择一种只与Fe3+反应的试剂,观察是否出现特征现象
d.加入足量铁粉,再向滤液中加入K3[Fe(CN)6](铁氰化钾)溶液进行检测.