题目内容
指出下列原子的杂化轨道类型及分子的结构式、立体构型并判断该分子的极性.
(1)H2S分子中的S采取 杂化,分子的结构式 ,立体构型 ,分子的极性 ;
(2)CH2O中的C采取 杂化,分子的结构式 ,立体构型 ,分子的极性 ;
(3)CH4分子中的C采取 杂化,分子的结构式 ,立体构型 ,分子的极性 .
(1)H2S分子中的S采取
(2)CH2O中的C采取
(3)CH4分子中的C采取
考点:原子轨道杂化方式及杂化类型判断,判断简单分子或离子的构型,极性分子和非极性分子
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定分子中原子杂化方式及分子空间构型,价层电子对个数=配原子个数+孤电子对个数,分子中正负电荷重心重合的为非极性分子,不重合的为非极性分子,据此分析解答.
解答:
解:(1)H2S分子中S原子价层电子对个数是4且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,结构式为 ,正负电荷重心不重合,为极性分子,
,正负电荷重心不重合,为极性分子,
故答案为:sp3; ;V;极性;
;V;极性;
(2)CH2O中的C价层电子对个数为3且不含孤电子对,所以采取sp2杂化,分子的结构式 ,立体构型平面三角形,该分子中正负电荷重心不重合,为极性分子,
,立体构型平面三角形,该分子中正负电荷重心不重合,为极性分子,
故答案为:sp2; ;平面三角形;极性;
;平面三角形;极性;
(3)CH4分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,分子的结构式 ,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子,故答案为:sp3;
,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子,故答案为:sp3; ;正四面体形;非极性.
;正四面体形;非极性.
 ,正负电荷重心不重合,为极性分子,
,正负电荷重心不重合,为极性分子,故答案为:sp3;
 ;V;极性;
;V;极性;(2)CH2O中的C价层电子对个数为3且不含孤电子对,所以采取sp2杂化,分子的结构式
 ,立体构型平面三角形,该分子中正负电荷重心不重合,为极性分子,
,立体构型平面三角形,该分子中正负电荷重心不重合,为极性分子,故答案为:sp2;
 ;平面三角形;极性;
;平面三角形;极性;(3)CH4分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,分子的结构式
 ,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子,故答案为:sp3;
,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子,故答案为:sp3; ;正四面体形;非极性.
;正四面体形;非极性.
点评:本题考查原子杂化方式、分子空间构型判断、分子极性判断等知识点,明确价层电子对互斥理论即可解答,难点是孤电子对个数的计算方法,题目难度不大.

练习册系列答案
相关题目
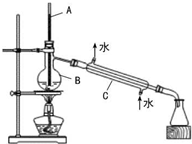 现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )
现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )| 物质 | 沸点/℃ | 溶解性 |
| 乙二醇 | 198 | 易溶于水和乙醇 |
| 丙三醇 | 290 | 能跟水、乙醇任意比互溶 |
| A、在正确操作情况下,锥形瓶中收集到的物质为乙二醇 |
| B、仪器C中进出水口方向错误 |
| C、仪器A为玻璃棒,所处位置错误 |
| D、仪器B的名称为圆底烧瓶. |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )


A、反应开始2 min内,v(B)=
| ||
| B、t1时改变的条件可能是升高温度 | ||
| C、t3时改变的条件可能是加压,此时c(B)不变 | ||
| D、t4时可能是使用了催化剂,此时c(B)不变 |
下列叙述正确的是( )
| A、为防止富脂食品氧化变质可以在包装袋中加入生石灰 |
| B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析 |
| C、绿色食品是不含任何化学物质的食品 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、同温同压下,相同体积的任何气体单质所含的原子数目相同 |
| B、1 mol过氧化钠中阴离子所带的负电荷数为2NA |
| C、常温常压下,11.2 L氮气所含的原子数目为NA |
| D、某温度时,pH=6的纯水中含10-6NA个OH- |
某有机物样品发现它们含有碳、氢、氧、氮等元素,这种样品很可能是( )
| A、油脂 | B、氨基酸 |
| C、葡萄糖 | D、淀粉 |
下列有关金属的说法正确的是( )
| A、生铁与钢的区别在于生铁含碳杂质,而钢不含 |
| B、铜在自然界中的含量高,所以铜是人类最早使用的金属 |
| C、黑色金属材料包括铁、铬、锰及其化合物 |
| D、金属一般都具有导电性、导热性、延展性 |
物质的量浓度相同的下列溶液,pH由小到大顺序排列的是( )
| A、(NH4)2SO4,NH4Cl,NaNO3,Na2S |
| B、Na2CO3,NaHCO3,NH4Cl,NaCl |
| C、Na2CO3,NaHCO3,NaCl,NH4Cl |
| D、NH4Cl,(NH4)2SO4,Na2S,NaNO3 |
 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为