题目内容
 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为(2)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为
②若实验室配制450mL1.19mol/L的稀盐酸,需用该浓盐酸
③在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度
(填“大于”“等于”或“小于”,下同).若盐酸溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度
考点:物质的量浓度的相关计算,物质的量的相关计算
专题:计算题
分析:(1)由质量守恒可知,生成C的质量为24g+40g-32g=32g,结合M=
计算;
(2)①根据c=
计算该浓盐酸中HCl的物质的量浓度;
②结合c1v1=c2V2计算;
③定容时仰视刻度线,水加多,溶液体积偏大;若盐酸溶液在转移至容量瓶时,洒落了少许,溶质减少,n偏小,结合c=
分析.
| m |
| n |
(2)①根据c=
| 1000ρw |
| M |
②结合c1v1=c2V2计算;
③定容时仰视刻度线,水加多,溶液体积偏大;若盐酸溶液在转移至容量瓶时,洒落了少许,溶质减少,n偏小,结合c=
| n |
| V |
解答:
解:(1)由质量守恒可知,生成C的质量为24g+40g-32g=32g,M=
=
=80g/mol,故答案为:80g/mol;
(2)由c=
可知,该浓盐酸中HCl的物质的量浓度为
=11.9mol/L,故答案为:11.9;
②由c1v1=c2V2可知,配制450mL1.19mol/L的稀盐酸,需用该浓盐酸为
=0.05L=50mL,故答案为:50;
③定容时仰视刻度线,水加多,溶液体积偏大,则由c=
可知,浓度;若盐酸溶液在转移至容量瓶时,洒落了少许,溶质减少,n偏小,由c=
可知,浓度偏小,
故答案为:小于;小于.
| m |
| n |
| 32g |
| 0.4mol |
(2)由c=
| 1000ρw |
| M |
| 1000×1.19×36.5% |
| 36.5 |
②由c1v1=c2V2可知,配制450mL1.19mol/L的稀盐酸,需用该浓盐酸为
| 0.5L×1.19mol/L |
| 11.9mol/L |
③定容时仰视刻度线,水加多,溶液体积偏大,则由c=
| n |
| V |
| n |
| V |
故答案为:小于;小于.
点评:本题考查物质的量及物质的量浓度的相关计算,为高频考点,把握物质的量、浓度、体积之间的关系及配制溶液的计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.(1)请指出图中有
a.一处 b.二处 c.三处 d.四处
(2)A仪器的名称是
下列有关溶液中微粒浓度关系的叙述正确的是( )
| A、0.1 mol?L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| D、25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
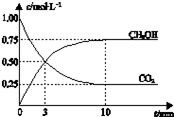 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种,向该溶液中加入溴水,再加入淀粉,溶液变蓝.由此可推断溶液中( )
| A、一定含有I-,不能确定是否含有Cl- |
| B、可能含有NO3-、Cl-和I- |
| C、可能含有NO3- |
| D、一定含有Fe3+ |
 用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.