题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、同温同压下,相同体积的任何气体单质所含的原子数目相同 |
| B、1 mol过氧化钠中阴离子所带的负电荷数为2NA |
| C、常温常压下,11.2 L氮气所含的原子数目为NA |
| D、某温度时,pH=6的纯水中含10-6NA个OH- |
考点:阿伏加德罗常数
专题:
分析:A、气体单质根据原子数目可以分为单原子分子、双原子分子和多原子分子;
B、过氧化钠中的阴离子为O22-;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
B、过氧化钠中的阴离子为O22-;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答:
解:A、气体单质根据原子数目可以分为单原子分子、双原子分子和多原子分子,故同温同压下,相同体积的单质气体所含的原子数不一定相同,故A错误;
B、过氧化钠中的阴离子为O22-,1mol过氧化钠含1molO22-,所带的电荷为2mol,个数为2NA,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,含有的氮原子小于1mol,故C错误;
D、溶液体积不明确,故D错误.
故选B.
B、过氧化钠中的阴离子为O22-,1mol过氧化钠含1molO22-,所带的电荷为2mol,个数为2NA,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,含有的氮原子小于1mol,故C错误;
D、溶液体积不明确,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
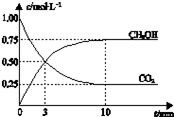 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
下列说法或表示法正确的是( )
| A、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石);△H=+1.19 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
下列对于苯的叙述正确的是( )
| A、易被强氧化剂KMnO4等氧化 |
| B、属于不饱和烃易发生加成反应 |
| C、虽然不饱和但比较易发生取代反应 |
| D、苯是一种重要的有机溶剂可广泛应用于生产绿色油漆等 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中 NO3-、I-、Na+、Al3+ |
