题目内容
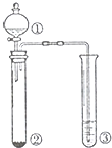
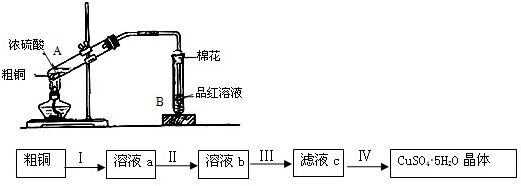
某研究小组用粗铜(含杂质铁)与一定体积浓硫酸反应进行实验研究(如图装置),并按下述流程除杂制备硫酸铜晶体(CuSO4?5H20)
请回答下列问题:
(1)试管A中开始反应时的主要化学方程式 ;
(2)若反应后A处有少量固体剩余,使其溶解的最好方法是 ;
(3)试管B中的实验现象是 ,使用浸润某种溶液的棉花的作用是 ;
(4)步骤Ⅱ中加入的试剂是双氧水,写出有关反应的离子方程式 ;
(5)步骤Ⅳ中,将溶液蒸发浓缩、冷却结晶后再进行 (填操作名称)可制得CuSO4?5H2O晶体,该操作所需的玻璃仪器有烧杯、漏斗和 (填仪器名称).

请回答下列问题:
(1)试管A中开始反应时的主要化学方程式
(2)若反应后A处有少量固体剩余,使其溶解的最好方法是
(3)试管B中的实验现象是
(4)步骤Ⅱ中加入的试剂是双氧水,写出有关反应的离子方程式
(5)步骤Ⅳ中,将溶液蒸发浓缩、冷却结晶后再进行
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2和H2O;
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫有毒,排入空气会污染大气;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4?5H2O晶体,根据仪器的作用选取仪器.
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫有毒,排入空气会污染大气;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4?5H2O晶体,根据仪器的作用选取仪器.
解答:
解:(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4
CuSO4+SO2↑+2H2O;
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水,双氧水具有氧化性,酸性条件下能将Cu氧化为铜离子,自身被还原为水,没有杂质产生,故答案为:加适量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色,所以B中的现象是品红溶液褪色;二氧化硫有毒,排入空气会污染大气,棉花的作用是吸收二氧化硫,防止污染大气,故答案为:溶液褪色;吸收二氧化硫;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水,离子方程式为Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4?5H2O晶体,过滤时需要烧杯、玻璃棒、漏斗,故答案为:过滤;玻璃棒.
| ||
故答案为:Cu+2H2SO4
| ||
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水,双氧水具有氧化性,酸性条件下能将Cu氧化为铜离子,自身被还原为水,没有杂质产生,故答案为:加适量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色,所以B中的现象是品红溶液褪色;二氧化硫有毒,排入空气会污染大气,棉花的作用是吸收二氧化硫,防止污染大气,故答案为:溶液褪色;吸收二氧化硫;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水,离子方程式为Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4?5H2O晶体,过滤时需要烧杯、玻璃棒、漏斗,故答案为:过滤;玻璃棒.
点评:本题考查探究铜和浓硫酸的反应,侧重考查学生实验操作能力、分析问题能力,涉及混合物的分离和提纯、氧化还原反应、离子方程式的书写等知识点,知道常见元素化合物性质,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③盐酸 Na[Al(OH)4]NaHSO4
④Ca(OH)2 Na2CO3 BaCl2.
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③盐酸 Na[Al(OH)4]NaHSO4
④Ca(OH)2 Na2CO3 BaCl2.
| A、①② | B、②③ |
| C、①③④ | D、①②④ |
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某试剂一段时间后,发现铜粉质量减少,溶液呈蓝色.加入试剂:①FeCl2;②Na2CO3;③KNO3;④FeSO4;⑤FeCl3;⑥H2O2;⑦NaClO;⑧NaOH.则该试剂可能是( )
| A、①④⑤ | B、②③⑦⑧ |
| C、③⑤⑥⑦ | D、全部 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
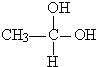 →CH3-CHO+H2O
→CH3-CHO+H2O

 已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题: