题目内容
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=
;②CO2 (g)═CO (g)+
O2(g);△H2=
则甲烷燃烧热的热化学方程式为 .
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中,以v(H2)表示的平均反应速率为: mol/L?min.
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要使实验3达到平衡状态时各物质的体积分数与实验2分别相等,则a、b应满足的关系是 (用含a、b表示).
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=
| -1214.6kJ |
| mol |
| 1 |
| 2 |
| +283kJ |
| mol |
则甲烷燃烧热的热化学方程式为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的正反应为
③若要使实验3达到平衡状态时各物质的体积分数与实验2分别相等,则a、b应满足的关系是
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)甲烷燃烧热的热化学方程式,应为1mol甲烷燃烧生成二氧化碳与液态水,根据盖斯定律构造;
(2)①根据v=
计算v(CO2),根据速率之比等于化学计量数之比计算v(H2);
②计算650℃、900℃的平衡常数,判断升高温度平衡的移动方向,根据温度对平衡移动影响判断;
③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可.
(2)①根据v=
| △c |
| △t |
②计算650℃、900℃的平衡常数,判断升高温度平衡的移动方向,根据温度对平衡移动影响判断;
③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可.
解答:
解:(1)已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②CO2 (g)═CO (g)+
O2(g);△H2=+283kJ/mol,
根据盖斯定律,①-②×2得2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H=-1780.66kJ/mol;
所以甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)①由表中数据可知,平衡时n(CO2)=1.6mol,所以v(CO2)=
=0.16mol/(L?min),根据速率之比等于化学计量数之比,所以v(H2)=v(CO2)=0.16mol/(L?min),故答案为:0.16;
②反应各组分的化学计量数为1,故可以用物质的量代替浓度计算平衡常数.
650℃时到达平衡:H2O(g)+CO(g)??CO2(g)+H2(g),
开始(mol):2 4 0 0
变化(mol):1.6 1.6 1.6 1.6
平衡(mol):0.4 2.4 1.6 1.6
所以650℃的平衡常数k=
=
900℃时到达平衡:H2O(g)+CO(g)??CO2(g)+H2(g),
开始(mol):1 2 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):0.6 1.6 0.4 0.4
所以900℃的平衡常数k=
=
.
升高温度平衡常数减小,即升高温度平衡向逆反应移动,升高温度向吸热反应移动,故正反应为放热反应,
故答案为:放;
③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可,即b=2a,故答案为:b=2a.
②CO2 (g)═CO (g)+
| 1 |
| 2 |
根据盖斯定律,①-②×2得2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H=-1780.66kJ/mol;
所以甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)①由表中数据可知,平衡时n(CO2)=1.6mol,所以v(CO2)=
| ||
| 5min |
②反应各组分的化学计量数为1,故可以用物质的量代替浓度计算平衡常数.
650℃时到达平衡:H2O(g)+CO(g)??CO2(g)+H2(g),
开始(mol):2 4 0 0
变化(mol):1.6 1.6 1.6 1.6
平衡(mol):0.4 2.4 1.6 1.6
所以650℃的平衡常数k=
| 1.6×1.6 |
| 0.4×2.4 |
| 8 |
| 3 |
900℃时到达平衡:H2O(g)+CO(g)??CO2(g)+H2(g),
开始(mol):1 2 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):0.6 1.6 0.4 0.4
所以900℃的平衡常数k=
| 0.4×0.4 |
| 0.6×1.6 |
| 1 |
| 6 |
升高温度平衡常数减小,即升高温度平衡向逆反应移动,升高温度向吸热反应移动,故正反应为放热反应,
故答案为:放;
③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可,即b=2a,故答案为:b=2a.
点评:本题考查元素化合物的推断、燃烧热及热化学方程式、化学反应速率与化学平衡计算、等效平衡等,难度中等,Ⅰ中关键是推断元素,需要学生具有扎实的基础,Ⅱ中(2)②为易错点,需要根据平衡常数判断,不是简单的平衡移动,注意平衡常数的运用.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液.则下列说法不正确的是( )
| A、试管塞越来越紧,是因为反应消耗了大量O2 |
| B、打开试管塞前Cu元素的化合价为+1价 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |
A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量是( )
A、
| ||
B、
| ||
| C、29mn | ||
D、
|
用以下三种途径来制取相同质量的硝酸铜:
①铜与浓硝酸反应
②铜与稀硝酸反应
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
下列叙述中错误的是( )
①铜与浓硝酸反应
②铜与稀硝酸反应
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
下列叙述中错误的是( )
| A、消耗的硝酸的量:①>②>③ |
| B、铜与浓硝酸作用最快,故最佳方案是① |
| C、对环境造成的危害,③最小 |
| D、三种途径所消耗的铜的质量相等 |
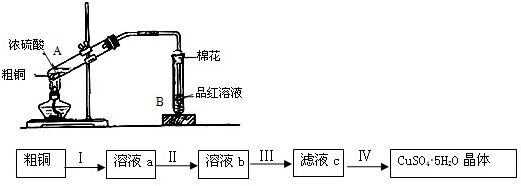

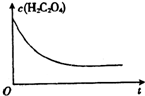 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.