题目内容
用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①改用60mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
①改用60mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
| A、①②④ | B、②③④ |
| C、①③④ | D、①②③④ |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:反应为CaCO3+2H+=Ca2++CO2↑+H2O,影响化学反应速率的因素有温度、浓度、压强、催化剂、x射线、固体物质的表面积等.增加反应物浓度,使反应速率加快;升高温度,使反应速率加快;对于有气体参与的化学反应,增大压强,使反应速率加快;增大接触面积,反应速率加快;使用正催化剂,使反应物速率加快,以此解答该题.
解答:
解:①改用60mL 3mol/L盐酸,体积增大,但浓度不变,反应速率不变,故错误;
②改用30mL 6mol/L盐酸,浓度增大,反应速率增大,故正确;
③改用3g粉末状大理石,固体表面积增大,反应速率增大,故正确;
④适当升高温度,活化分子百分数增大,反应速率增大,故正确.
故选B.
②改用30mL 6mol/L盐酸,浓度增大,反应速率增大,故正确;
③改用3g粉末状大理石,固体表面积增大,反应速率增大,故正确;
④适当升高温度,活化分子百分数增大,反应速率增大,故正确.
故选B.
点评:本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
下列反应原理不符合工业冶炼金属实际情况的是( )
A、2HgO
| ||||
B、2NaCl(熔融)
| ||||
C、2MgO(熔融)
| ||||
D、Fe2O3+3CO
|
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol Na2O2跟 H2O反应转移电子的数目为2NA |
| B、1 mol氯气跟NaOH反应转移电子的数目为NA |
| C、常温常压下,22.4 L氯气所含原子数为2NA |
| D、标准状况下,22.4 L蒸馏水所含分子数为NA |
在温度和压强不变的情况下,反应2NO2?2NO+O2达到平衡,若反应前NO2为0.5L,反应后混合气体的体积变为0.65L,则NO2的分解率是( )
| A、15% | B、20% |
| C、60% | D、75% |
下列说法中正确的是( )
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C、反应产物的总能量大于反应物的总能量时,△H>0 |
| D、△H的大小与热化学方程式的计量系数无关 |
最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A、该晶体类型是原子晶体 |
| B、该晶体中碳原子和氧原子的个数比为1:2 |
| C、每摩尔该晶体中含4molC-O |
| D、晶体的空间最小环共有6个原子构成 |
下列叙述正确的是( )
| A、1.00molNaCl中含有6.02×1023个NaCl分子 |
| B、欲配置1.00L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| C、1molNO2和N2O4混合气体中含有原子总数为3NA |
| D、1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 |
 的系统命名是:
的系统命名是: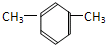 的名称是
的名称是 的系统命名是
的系统命名是