题目内容
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、若“M+N=X+Y”为放热反应,则1mol X和1mol Y的总能量一定大于1mol M和1mol N的总能量 |
| C、“H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol”表示1分子H2和1分子Cl2反应,放出热量183kJ |
| D、化学反应必然引起化学键的变化,化学反应也必然伴随能量的变化 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、反应热与反应条件无关;
B、反应物能量高于生成物时反应放热;
C、热化学方程式中的化学计量数只表示物质的量,不表示分子个数;
D、从化学反应的实质分析解答.
B、反应物能量高于生成物时反应放热;
C、热化学方程式中的化学计量数只表示物质的量,不表示分子个数;
D、从化学反应的实质分析解答.
解答:
解:A、燃烧都需要加热到着火点但都是放热反应,故A错误;
B、放热反应的反应物能量高于生成物,故B错误;
C、热化学方程式中的化学计量数只表示物质的量,不表示分子个数,故C错误;
D、化学反应的实质就是旧键断裂新键形成的过程,断键吸收能量,成键释放能量,故D正确;
故选D.
B、放热反应的反应物能量高于生成物,故B错误;
C、热化学方程式中的化学计量数只表示物质的量,不表示分子个数,故C错误;
D、化学反应的实质就是旧键断裂新键形成的过程,断键吸收能量,成键释放能量,故D正确;
故选D.
点评:本题考查了焓变与反应条件无关、放热反应与物质能量的关系、热化学方程式的化学计量数、化学反应的实质,题目难度不大.

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
120℃,某气态烃在密闭容器中与足量的O2混合点燃,完全燃烧后恢复至原温度,容器内的压强保持不变,则该烃是( )
| A、CH4 |
| B、C2H6 |
| C、C3H6 |
| D、C3H8 |
下列离子方程式正确的是( )
| A、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | ||||
| B、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | ||||
C、H
| ||||
| D、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
下列反应原理不符合工业冶炼金属实际情况的是( )
A、2HgO
| ||||
B、2NaCl(熔融)
| ||||
C、2MgO(熔融)
| ||||
D、Fe2O3+3CO
|
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol Na2O2跟 H2O反应转移电子的数目为2NA |
| B、1 mol氯气跟NaOH反应转移电子的数目为NA |
| C、常温常压下,22.4 L氯气所含原子数为2NA |
| D、标准状况下,22.4 L蒸馏水所含分子数为NA |
下列叙述正确的是( )
| A、1.00molNaCl中含有6.02×1023个NaCl分子 |
| B、欲配置1.00L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| C、1molNO2和N2O4混合气体中含有原子总数为3NA |
| D、1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 |
 的系统命名是:
的系统命名是: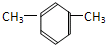 的名称是
的名称是 的系统命名是
的系统命名是