题目内容
11.已知短周期元素的离子,A2+、B+、C2-、D-都具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
分析 短周期元素的离子A2+、B+、C2-、D-都具有相同的电子层结构,则离子具有2个电子层,结合离子所带电荷可知A为Mg、B为Na、C为O、D为F,结合元素周期律解答.
解答 解:短周期元素的离子A2+、B+、C2-、D-都具有相同的电子层结构,则离子具有2个电子层,结合离子所带电荷可知A为Mg、B为Na、C为O、D为F.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:B(Na)>A(Mg)>C(O)>D(F),故A错误;
B.原子序数Mg>Na>F>O,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,故C正确;
D.金属性越强单质还原性越强,故还原性Na>Mg,氧、氟单质表现氧化性,氟气氧化性更强,故D错误.
故选:C.
点评 本题考查结构性质位置关系、元素周期律等,关键是根据短周期元素离子结构特点推断元素,也可以不推断具体元素,确定在周期表中相对位置,根据元素周期律进行解答.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
1.某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是( )
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Al3+ Cl- | ||
| C. | K+ Na+ Cl- SO42- | D. | K+ Cl- Ba2+ HCO3- |
19.已知下述三个实验均能发生化学反应.
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中,当转移0.2mol电子时,有0.1mol的Fe2+被氧化 | |
| D. | 实验③中反应的离子方程式为:Fe+Fe3+═2Fe2+ |
6.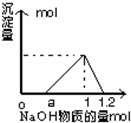 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )| A. | 1:3 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
16.有机物甲的分子式为C7H14O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙两种有机物的蒸气所占体积相同,则甲的可能结构为( )
| A. | 2 种 | B. | 4 种 | C. | 8 种 | D. | 16 种 |
20.下列物质与苯酚互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |