题目内容
19.实验探究是体验知识的产生和形成过程的基本途径.某化学兴趣小组为探究元素性质递变规律,设计了如下实验:试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
| 实验方案(只要求填写选用试剂) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 实验现象 | 针对方程式①②或③试管中先生成白色沉淀,后白色沉淀消失. 针对方程式④:试管中有白色沉淀. | 溶液由浅黄绿色变成橙黄色 |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
分析 同周期元素的原子,从左到右元素的金属性逐渐减弱,可以根据金属和酸或水反应置换出氢气的难易程度来判断,或者根据最高价氧化物对应水化物的碱性强弱来回答,氢氧化铝是两性氢氧化物而氢氧化镁属于碱;从左到右元素的非金属性逐渐增强,氧化性强的可以将氧化性弱的从盐中置换出来,据此判断Cl、Br的非金属性,据此分析解答.
解答 解:(1)试管中有白色沉淀道用到的试剂有:AlCl3溶液、MgCl2溶液、NaOH溶液,根据方程式①Al3++3OH-═Al(OH)3↓、②Al(OH)3+OH-═AlO2-+H2O、③Al3++4OH-═AlO2-+2H2O可知试管中先生成白色沉淀,后白色沉淀消失,氢氧化铝既可以和强酸反应还可以和强碱反应,是两性氢氧化物;
方程式④中的现象:试管中有白色沉淀,离子方程式为为:Mg2++2OH-═Mg(OH)2↓,说明氢氧化镁只能和强酸反应,不能溶于强碱,氢氧化镁属于碱;
即碱性:氢氧化镁>氢氧化铝,可以证明金属镁的活泼性强于金属铝;
(2)氯气的氧化性强于溴单质,氧化性强的可以将氧化性弱的从盐中置换出来,根据氯气能置换溴单质可以得出Cl的非金属性强于Br,原理方程式为:2Br-+Cl2═Br2+2Cl-,用到的试剂是:氯水、NaBr溶液,故答案为:
| 实验方案 (只要求填写选用试剂) | (1) | (2) |
| 氯水、NaBr溶液 | ||
| 实验现象 | 试管中先生成白色沉淀,后白色沉淀消失; | |
| 有关反应的离子方程式 | ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
点评 本题是一道考查元素周期律应用知识的综合实验探究题目,综合性强,结合表中数据分析是解题的关键,难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
8.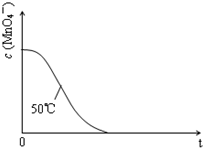 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移2mol 电子.为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥2.5.
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).
 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).
 .
.