题目内容
10.下列用来表示物质变化的反应式中,错误的是( )①钢铁腐蚀时可能发生的正极反应:2H2O+O2=4e-=4OH-
②向KHSO4溶液中滴入Ba(OH)2溶液至pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O
③明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+
④苯酚钠溶液中通入少量二氧化碳:2C6H6O-+CO2+H2O→2C6H5OH+CO32-.
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ②④ |
分析 ①钢铁腐蚀时正极得到电子发生还原反应,在弱酸性或中性条件下氧气得到电子生成氢氧根离子;
②向KHSO4溶液中滴入Ba(OH)2溶液至pH=7,则氢离子与氢氧根离子恰好反应,硫酸氢钾和氢氧化钡按照物质的量2:1反应;
③明矾电离出的铝离子发生水解生成氢氧化铝和氢离子;
④苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠.
解答 解:①在弱酸性或中性条件下,钢铁腐蚀时正极氧气得到电子,正极反应为:2H2O+O2=4e-=4OH-,故①正确;
②向KHSO4溶液中滴入Ba(OH)2溶液至pH=7,溶液呈中性,氢离子与氢氧根离子恰好反应,正确的离子方程式为:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O,故②错误;
③明矾在溶液中电离出铝离子,铝离子发生水解的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故③正确;
④苯酚钠溶液中通入少量二氧化碳,由于苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子,正确的离子方程式为:C6H6O-+CO2+H2O→C6H5OH+HCO3-,故④错误;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,④为易错点,注意苯酚的酸性大于碳酸氢根离子,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
20.下列物质与苯酚互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
18.有机物M可用于合成香料,其结构简式如图所示.下列有关说法不正确的是( )
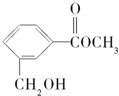

| A. | 有机物M中有2种含氧官能团 | |
| B. | 1mol有机物M可与1mol NaOH发生反应 | |
| C. | 有机物M能与溴水发生加成反应 | |
| D. | 1mol有机物M最多能与3mol H2反应 |
15.X酯完全燃烧生成CO2和水的物质的量之比为1:1,X经过水解得B和C,C氧化可得到B,则X酯为( )
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
8. 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移2mol 电子.为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥2.5.
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
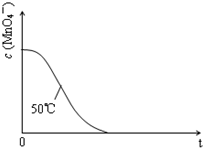
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).
 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).