题目内容
12.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| B. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 常温下,5.6g Fe片投入到足量的浓硝酸中,转移电子数为0.3NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA |
分析 A.熔融的NaHSO4中含有的阳离子只有钠离子;
B.二氧化硫与氧气的反应为气体体积缩小的可逆反应;
C.常温下铁在浓硝酸中发生钝化;
D.乙烯和丙烯最简式相同为CH2,只需要计算14gCH2中原子数;
解答 解:A.12.0g熔融的NaHSO4的物质的量为0.1mol,0.1mol熔融硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,所以含有的阳离子数为0.1NA,故A正确;
B.2mol二氧化硫与1mol氧气反应生成的三氧化硫小于2mol,该反应是气体体积缩小的反应,则反应后气体的总物质的量大于2mol,所得混合气体的分子数大于2NA,故B正确;
C.常温下铁在浓硝酸中发生钝化,不能继续反应,故C错误;
D.14g乙烯和丙烯的混合气体中含有的原子数,乙烯和丙烯最简式相同为CH2,只需要计算14 gCH2中原子数=$\frac{14g}{14g/mol}$×3NA=3NA,故D正确;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意可逆反应、钝化现象和物质结构的理解应用,题目难度不大.

练习册系列答案
相关题目
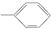
20.下列物质与苯酚互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
17.某有机物M的蒸气与相同状况下同体积氧气的质量比是30,其分子中碳、氢的质量分数分别是40%、6.6%,其余为氧.有机物M的分子式为( )
| A. | CH2O | B. | C2H4O | C. | C2H4O2 | D. | C3H8O |
4.下列离子方程式正确的是( )
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
 ⑤-CHO.
⑤-CHO.