题目内容
2.某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和5.4gH2O.下列说法正确的是( )| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 该有机物的分子式为C2H6 | D. | 该化合物中一定含有氧元素 |
分析 化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,根据n=$\frac{m}{M}$计算二氧化碳、水的物质的量,进而计算有机物中C、H原子数目之比,根据m=nM计算C、H元素质量,根据质量守恒定律计算判断化合物中是否含有O元素.
解答 解:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,
8.8g二氧化碳的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
7.2g水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,
故化合物中N(C):N(H)=0.2mol:0.4mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,
故选D.
点评 本题考查有机物组成的确定,侧重考查质量守恒定律,题目难度不大,注意根据质量守恒判断是否含有氧元素.

练习册系列答案
相关题目
13.元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
17.实验室制氯气时有如下操作,操作顺序正确的是( )
①连好装置,检查气密性;
②缓缓加热;
③加入二氧化锰粉末;
④从装有浓盐酸的分液漏斗中放出浓盐酸;
⑤将多余的氯气用氢氧化钠溶液吸收;
⑥向上排放收集氯气.
①连好装置,检查气密性;
②缓缓加热;
③加入二氧化锰粉末;
④从装有浓盐酸的分液漏斗中放出浓盐酸;
⑤将多余的氯气用氢氧化钠溶液吸收;
⑥向上排放收集氯气.
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①④③②⑥⑤ | D. | ①③④②⑥⑤ |
14.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | B. | 气态氢化物稳定性为:ZH3>H2Y>HX | ||
| C. | 非金属性:X>Y>Z | D. | 原子半径:X>Y>Z |
11.下列说法中错误的是( )
| A. | 氯气是一种黄绿色、有刺激性气味的气体 | |
| B. | 氯气、液氯和氯水是同一种物质 | |
| C. | 氯气能溶于水 | |
| D. | 氯气是一种有毒的气体,可用NaOH溶液吸收 |
 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题: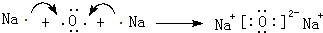 、
、 .
.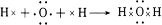 、
、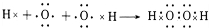 .
.