题目内容
19.下列说法正确的是( )| A. | 氢氧化铁胶体属于纯净物 | B. | CO是酸性氧化物 | ||
| C. | 纯碱属于碱类物质 | D. | BaSO4是强电解质 |
分析 A.纯净物是一种物质组成的物质;
B.和碱反应生成盐和水的氧化物;
C.纯碱为盐;
D.水溶液中或熔融状态下完全电离的化合物为电解质.
解答 解:A.氢氧化铁胶体是分散系属于混合物,故A错误;
B.CO和碱不反应属于不成盐氧化物,故B错误;
C.纯碱是碳酸钠属于盐类物质,故C错误;
D.BaSO4熔融状态完全电离是强电解质,故D正确;
故选D.
点评 本题考查了物质分类、物质组成,主要是纯净物、酸性氧化物、强电解质等概念的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
9.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=489.0kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
14.向淀粉溶液中加入少量的稀硫酸,加热使之发生水解,为测定水解程度,需要加入下列试剂中的①NaOH溶液;②银氨溶液;③新制的Cu(OH)2悬浊液;④碘水;⑤BaCl2溶液,组合正确的是( )
| A. | ①⑤ | B. | ②④ | C. | ①②④ | D. | ②③④ |
4.下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
| A. | 盐--①④ | B. | 碱--①⑥ | C. | 纯净物--③④⑤ | D. | 混合物--②⑤ |
11.某化学课外活动小组组装了如图所示的西红柿电池,下列有关该电池的说法正确的是( )


| A. | 铜作负极 | B. | 锌作正极 | ||
| C. | 电子由铜经导线流向锌 | D. | 锌片上的反应为:Zn-2e-=Zn2+ |
8.在溶液导电性实验装置里,分别注入20mL 6mol•L-1醋酸和20mL 6mol•L-1氨水,灯光明暗程度相似,如果把这两种溶液混和后再试验则( )
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光明暗程度变化不明显 | D. | 灯光变亮 |
1.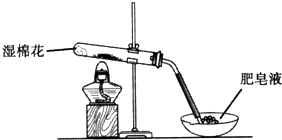 某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
(1)实验前检查装置气密性的方法为将导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱.
(2)检验实验中生成气体的实验操作是点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁出现液滴,证明生成了H2.
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
①乙组得到的黑色粉末是Fe.
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+;溶液褪色可能的原因是可能是Cl2将SCN-氧化;验证方法为再继续加入KSCN溶液则溶液变红.
 某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.(1)实验前检查装置气密性的方法为将导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱.
(2)检验实验中生成气体的实验操作是点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁出现液滴,证明生成了H2.
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+;溶液褪色可能的原因是可能是Cl2将SCN-氧化;验证方法为再继续加入KSCN溶液则溶液变红.