题目内容
4.下列物质分类全部正确的是( )①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
| A. | 盐--①④ | B. | 碱--①⑥ | C. | 纯净物--③④⑤ | D. | 混合物--②⑤ |
分析 阴离子是酸根离子、阳离子是金属离子或铵根离子的化合物为盐;
电离出的阴离子全部是氢氧根的化合物为碱;
只由一种物质构成的为纯净物;
由两种或以上物质构成的是混合物.
解答 解:①纯碱是碳酸钠,是盐,是纯净物; ②食盐水是有氯化钠和水构成的混合物; ③石灰水是由氢氧化钙和水构成的混合物; ④NaHSO4是盐,是纯净物;⑤液态氧是单质,是纯净物; ⑥NaOH是碱,是化合物,也是纯净物.
A、①④是盐,故A正确;
B、⑥是碱,①是盐不是碱,故B错误;
C、③是混合物,故C错误;
D、⑤是纯净物,故D错误.
故选A.
点评 本题考查了盐、碱、纯净物和混合物的概念和区别,难度不大,应注意的是液态氧是氧气,是单质,也是纯净物.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 | |
| D. | C(石墨,s)═C(金刚石,s)△H>0,所以石墨比金刚石稳定 |
12.下列属于吸热反应的是( )
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O和NH4Cl反应.
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O和NH4Cl反应.
| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
19.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | CO是酸性氧化物 | ||
| C. | 纯碱属于碱类物质 | D. | BaSO4是强电解质 |
9.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 常温下,C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 任何能使熵值增大的过程都能自发进行 | |
| D. | 反应物和生成物所具有的总焓决定了反应是否能自发进行 |
16.下列离子方程式书写正确的是( )
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
13.离子方程式CO32-+2H+═CO2↑+H2O表示( )
| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
6.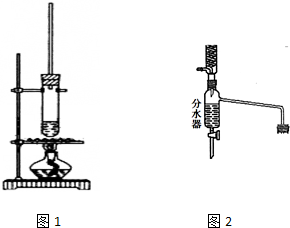 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应.
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤.
将酯层进行蒸馏.蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5.12 g.
已知:
完成下列填空:
(1)如图装置中长导管有冷凝回流作用,它可以由分水回流装置代替.分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去.
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用.可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高
使用分水器装置进行回流的可逆反应反应,一般应具备条件.有水生成,回流有机物位于水上层(反应温度100℃左右)
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水.
预先加水的目的是.回流的有机物能及时返回反应体系
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是.乙酸、正丁醇大量挥发,发生副反应.
(4)水洗的目的是.除去水溶性杂质碱洗的目的是.除去酸性杂质测pH值的操作.pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值.
(5)本次实验乙酸正丁酯的产率.54.5%.
 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应.
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤.
将酯层进行蒸馏.蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5.12 g.
已知:
| 物质 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
(1)如图装置中长导管有冷凝回流作用,它可以由分水回流装置代替.分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去.
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用.可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高
使用分水器装置进行回流的可逆反应反应,一般应具备条件.有水生成,回流有机物位于水上层(反应温度100℃左右)
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水.
预先加水的目的是.回流的有机物能及时返回反应体系
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是.乙酸、正丁醇大量挥发,发生副反应.
(4)水洗的目的是.除去水溶性杂质碱洗的目的是.除去酸性杂质测pH值的操作.pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值.
(5)本次实验乙酸正丁酯的产率.54.5%.