题目内容
9.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=489.0kJ•mol-1CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
分析 ①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=489.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1,
由盖斯定律可知,③×6-②×6-①×2得到4Fe(s)+3O2(g)═2Fe2O3(s),以此计算△H.
解答 解:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=489.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1,
由盖斯定律可知,③×6-②×6-①×2得到4Fe(s)+3O2(g)═2Fe2O3(s),其△H=(-393.5kJ•mol-1)×6-(-283.0kJ•mol-1)×6-(489.0kJ•mol-1)×2=-1 641.0 kJ•mol-1,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、已知反应与目标反应的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
19.某研究性学习小组成员分别设计了如下甲、乙、丙三套实验装置制取乙酸乙酯.请回答下列问题:

(1).写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
(2).甲、乙、丙三套实验装置中,不宜选用的装置是丙 (填甲、乙、丙)
(3).现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图,请回答.

试剂a是饱和碳酸钠溶液;分离方法①是分液,分离方法②是蒸馏.
(4).为了证明浓硫酸在反应中起到了催化剂和吸水剂的作用,某同学利用上图中某装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是3mL和4 mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

(1).写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
(2).甲、乙、丙三套实验装置中,不宜选用的装置是丙 (填甲、乙、丙)
(3).现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图,请回答.

试剂a是饱和碳酸钠溶液;分离方法①是分液,分离方法②是蒸馏.
(4).为了证明浓硫酸在反应中起到了催化剂和吸水剂的作用,某同学利用上图中某装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
4.通过以下反应均可获取H2,下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H3=74.8kJ•mol-1 |
14.下列说法正确的是( )
| A. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 | |
| D. | C(石墨,s)═C(金刚石,s)△H>0,所以石墨比金刚石稳定 |
18.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )
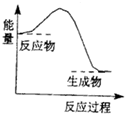

| A. | 生石灰溶于水 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4C1固体的反应 |
19.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | CO是酸性氧化物 | ||
| C. | 纯碱属于碱类物质 | D. | BaSO4是强电解质 |