题目内容
8.在溶液导电性实验装置里,分别注入20mL 6mol•L-1醋酸和20mL 6mol•L-1氨水,灯光明暗程度相似,如果把这两种溶液混和后再试验则( )| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光明暗程度变化不明显 | D. | 灯光变亮 |
分析 电解质溶液导电性取决于离子浓度的大小,醋酸和氨水两者混合生成强电解醋酸铵,导电能力增强.
解答 解:在相同温度下分别注入20mL 6mol•L-1醋酸和20mL6mol•L-1氨水,灯光明暗程度相同,说明两溶液中离子浓度一样,电离常数醋酸等于氨水;醋酸和氨水两者混合生成强电解醋酸铵,完全电离,自由移动离子浓度变大,导电能力增强,灯光变亮,故选D.
点评 本题考查电解质溶液导电性,为高频考点,侧重考查学生分析判断能力,溶液导电性强弱与溶液中离子浓度、离子所带电荷成正比,与电解质强弱无关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )
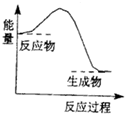

| A. | 生石灰溶于水 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4C1固体的反应 |
19.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | CO是酸性氧化物 | ||
| C. | 纯碱属于碱类物质 | D. | BaSO4是强电解质 |
16.下列离子方程式书写正确的是( )
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
13.离子方程式CO32-+2H+═CO2↑+H2O表示( )
| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
20.如图是某学校实验室买回的硫酸试剂标签的部分内容.判断下列说法正确的是( )


| A. | 该硫酸的浓度为9.2 mol•L-1 | |
| B. | 配制480 mL 4.6 mol•L-1的稀硫酸需该H2SO4 125mL | |
| C. | 该硫酸与等体积水混合质量分数变为49% | |
| D. | 取该硫酸100 mL,则浓度变为原来的$\frac{1}{5}$ |
17.已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |
 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.