题目内容
7.高铁酸钠(化学式为Na2FeO4)是一种新型净水剂,工业上常通过如下化学反应制取:Fe2O3+3NaNO3+4NaOH═2Na2FeO4+3NaNO2+2H2O.
该反应中:Na2FeO4中铁的化合价为+6,氧化剂为NaNO3,发生氧化反应的物质为Fe2O3,氧化产物为Na2FeO4,还原产物为NaNO2,电子转移数目为6个.
分析 Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2H2O中,根据化合价代数和为0,不难计算出Na2FeO4中铁的化合价为+6,则反应中Fe元素的化合价由+3价升高为+6价,N元素的化合价由+5价降低为+3价,以此来解答.
解答 解:根据化合价代数和为0,不难计算出Na2FeO4中铁的化合价为+6,N元素的化合价由+5价降低为+3价,则NaNO3为氧化剂,生成NaNO2为还原产物,反应中Fe元素的化合价由+3价升高为+6价,则Fe2O3为还原剂,发生氧化反应,生成Na2FeO4为氧化产物,电子转移数目为2×(6-3)=6个;故答案为:+6;NaNO3;Fe2O3;Na2FeO4;NaNO2;6.
点评 本题考查氧化还原反应,为高频考点,明确各元素的化合价变化是解答该题的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )
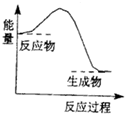

| A. | 生石灰溶于水 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4C1固体的反应 |
12.下列属于吸热反应的是( )
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O和NH4Cl反应.
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O和NH4Cl反应.
| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
19.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | CO是酸性氧化物 | ||
| C. | 纯碱属于碱类物质 | D. | BaSO4是强电解质 |
16.下列离子方程式书写正确的是( )
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
17.已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |