题目内容
3.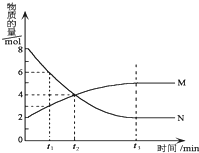 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
分析 A.由图可知,N减少,M增加,利用量的变化来分析判断;
B.根据反应速率v=$\frac{△n}{V•△t}$计算;
C.t2之后M、N的物质的量还在变化,因此反应没有达到平衡状态,t2时正逆反应速率不相等;
D.t3时M、N的物质的量不随时间改变而改变,反应达到化学平衡状态.
解答 解:A.由图可知,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,N为反应物,M为生成物,变化量之比为2:1,即化学计量数之比为2:1,反应为2N?M,故A错误;
B.反应开始至t1时间段M 的反应速率v(M)=$\frac{3mol-2mol}{V×1min}$,V不知,因此无法计算出1mol﹒L-1﹒min-1,故B错误;
C.t2之后M、N的物质的量还在变化,因此反应没有达到平衡状态,t2时正逆反应速率不相等,故C错误;
D.t3时M、N的物质的量不随时间改变而改变,反应达到化学平衡状态,正反应速率等于逆反应速率,故D正确;
故选D.
点评 本题考查了根据图象计算化学反应速率、判断化学平衡状态的问题,难度不大,注意把握图象的分析.

练习册系列答案
相关题目
11.下列说法一定错误的是( )
| A. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| B. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,Rn元素的相对原子质量是222 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 112号元素属于过渡元素 |
18.下列有关物质说法正确的是( )
| A. | 加热NH4Cl只破坏离子键 | |
| B. | 4.48L氨气中含有0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 甲烷的结构式:CH4 | B. | NH4Cl的电子式: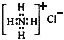 | ||
| C. | 苯的实验式:CH | D. | 乙烯的结构简式:C2H4 |
13.下列解释事实的方程式正确的是( )
| A. | 明矾可作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 盛装NaOH溶液的试剂瓶不用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| C. | NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2Cl--2e-=Cl2↑ |
 元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小.依据信息,回答下列问题:
元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小.依据信息,回答下列问题: .
.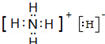 ,常温下A与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,常温下A与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
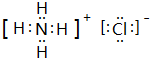 ,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).
,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).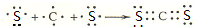 .
.