题目内容
14. 元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小.依据信息,回答下列问题:
元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小.依据信息,回答下列问题:(1)Q的核外电子排布图为
 .
.(2)除X外,其余元素的第一电离能由小到大的顺序为B<C<O<N<F(用元素符号作答).
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体.写出A的电子式
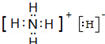 ,常温下A与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
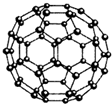
,常温下A与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形.Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为C60F60.
分析 元素周期表中前两周期的六种元素价电子数之和为26,价电子只能为1、3、4、5、6、7,而元素X、Y、Z、M、N、Q原子序数依次增大,原子半径依Y、Z、M、N、Q、X依次减小,则X为H元素,Y为B、Z为C、M为N、N为O、Q为F.
(1)Q为F,原子核外电子排布式为1s22s22p5,根据泡利原理、洪特规则画出排布图;
(2)同周期随原子序数增大,元素第一电离能呈增大强酸,但ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的;
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,应为铵盐,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体,该化合物为NH4H,组成中含N元素的质量分数为73.7%,符合题意;
(4)C60分子中每个碳原子形成多边形边数为3,则分子含有边数为$\frac{60×3}{2}$=90,即分子中含有的碳碳单键、与碳碳双键数目之和为90,每个碳原子形成4对共用电子对,故每个碳原子形成3个边中有2个碳碳单键、1个碳碳双键,则含有碳碳双键数目为90×$\frac{1}{3}$=30,碳碳双键与氟气发生加成反应.
解答 解:元素周期表中前两周期的六种元素价电子数之和为26,价电子只能为1、3、4、5、6、7,而元素X、Y、Z、M、N、Q原子序数依次增大,原子半径依Y、Z、M、N、Q、X依次减小,则X为H元素,Y为B、Z为C、M为N、N为O、Q为F.
(1)Q为F,原子核外电子排布式为1s22s22p5,核外电子排布图为: ,
,
故答案为: ;
;
(2)同周期随原子序数增大,元素第一电离能呈增大强酸,但ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,除氢外,其余元素的第一电离能由小到大的顺序为:B<C<O<N<F,
故答案为:B<C<O<N<F;
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,应为铵盐,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体,该化合物为NH4H,组成中含N元素的质量分数为73.7%,符合题意,电子式为: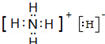 ,与水反应方程式为:NH4H+H2O=NH3•H2O+H2↑,
,与水反应方程式为:NH4H+H2O=NH3•H2O+H2↑,
故答案为: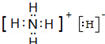 ;NH4H+H2O=NH3•H2O+H2↑;
;NH4H+H2O=NH3•H2O+H2↑;
(4)C60分子中每个碳原子形成多边形边数为3,则分子含有边数为$\frac{60×3}{2}$=90,即分子中含有的碳碳单键、与碳碳双键数目之和为90,每个碳原子形成4对共用电子对,故每个碳原子形成3个边中有2个碳碳单键、1个碳碳双键,则含有碳碳双键数目为90×$\frac{1}{3}$=30,1mol C60与30mol氟气发生加成反应,故则加成产物的化学式为C60F60,
故答案为:C60F60.
点评 本题是对物质结构与性质的考查,推断元素是解题关键,涉及核外电子排布、元素周期律、无机物推断、晶胞结构与计算,(4)中注意利用均摊法计算碳碳单键与碳碳双键数目,难度中等.


| A. | 拉瓦锡研究了空气的成分,让大家认识了氧气 | |
| B. | 图为雾霾的主要成分示意图,汽车尾气的大量排放是造成雾霾天气的人为因素之一 | |
| C. | “滴水石穿、绳锯木断、落汤螃蟹着红袍”均不包含化学变化 | |
| D. | “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态 |
| A. | pH=4 | B. | c(H+)=0.001 mol•L-1 | ||
| C. | c(OH- )=1×10-11 mol•L-1 | D. | c(H+):c(OH- )=1×104 |
| A. | 任何晶体中都存在化学键 | |
| B. | 固体SiO2一定是晶体 | |
| C. | 晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象 | |
| D. | X-射线衍射法是区分晶体和非晶体的唯一方法 |
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
| A. | Z的气态氢化物稳定性强于其它的非金属气态氢化物 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ23种化合物中,阳离子与阴离子个数比均为1:2 |
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
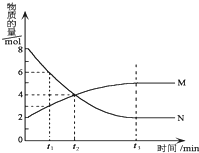 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |