题目内容
18.BaCl2•xH2O是用途广泛的基础化工产品.我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2•xH2O,工艺流程如图所示.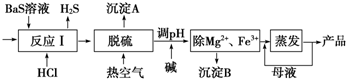
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为2(NH4)2S+O2+2H2O═4NH3•H2O+2S↓.
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是升高温度,减小气体在溶液中的溶解度,利于吹除硫化氢;沉淀A的主要成分是S.
(3)热空气吹除时会有部分HS-转变为S2O${\;}_{3}^{2-}$,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为S2O32-+2H+═S↓+SO2↑+H2O.
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是Fe3+,另一离子浓度为0.18mol/L(当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀).
若向0.1mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象产生红褐色沉淀并有气体放出,发生反应的离子方程式2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑.
(5)将足量的SO2气体通入BaCl2溶液中有无明显现象无(填“有”或“无”),向NaOH溶液中通入足量的SO2气体,写出所得溶液离子浓度的大小顺序c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
分析 用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2•xH2O,硫化钡(含少量Mg2+、Fe3+等)和盐酸反应生成硫化氢气体,所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,硫化氢被氧气氧化生成沉淀A为单质硫,加入碱溶液调节溶液PH除去Mg2+和Fe3+,得到沉淀B为Mg(OH)2和Fe(OH)3,得到氯化钡溶液蒸发浓缩得到氯化钡晶体,其中得到的母液循环使用,
(1)H2S用足量氨水吸收,会生成硫化铵,空气中的氧气能将硫化铵氧化成硫单质,据此写化学方程式;
(2)预热后的空气能使溶液温度升高,从而减小气体在溶液中的溶解度,利于吹除硫化氢,同时空气中有氧气,能将部分硫化氢氧化成硫单质而形成沉淀;
(3)S2O32-在酸性条件下发生自身氧化还原反应生成二氧化硫和硫单质,根据电荷守恒和元素守恒可写出离子方程式;
(4)根据Ksp[Mg(OH)2]=1.8×10-11可知,要使Mg 2+沉淀完全,溶液中c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{1×1{0}^{-5}}}$mol/L=1.34×10-3mol/L,c(H+)=$\frac{1{0}^{-14}}{1.34×1{0}^{-3}}$=7.5×10-12mol/L,则沉淀完全的PH值为12-lg7.5,根据Ksp[Fe(OH)3]=4.0×10-38要使Fe 3+沉淀完全,溶液中c(OH-)=$\root{3}{\frac{4×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=$\root{3}{4×1{0}^{-33}}$mol/L=1.6×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1.6×1{0}^{-11}}$=6.25×10-4mol/L,PH=4-lg6.25,所以当Mg 2+沉淀完全时Fe 3+早已沉淀完全,依据溶度积常数计算镁离子浓度;若向0.1mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液发生双水解反应生成氢氧化铁、二氧化碳;
(5)二氧化硫和氯化钡溶液不发生反应,向NaOH溶液中通入足量的SO2气体反应生成亚硫酸氢钠溶液,亚硫酸氢根离子电离大于水解程度溶液显酸性.
解答 解:(1)H2S用足量氨水吸收,会生成硫化铵,空气中的氧气能将硫化铵氧化成硫单质,反应的化学方程式为2(NH4)2S+O2+2H2O=4NH3•H2O+2S↓,
故答案为:2(NH4)2S+O2+2H2O=4NH3•H2O+2S↓;
(2)预热后的空气能使溶液温度升高,从而减小气体在溶液中的溶解度,利于吹除硫化氢,同时空气中有氧气,能将部分硫化氢氧化成硫单质而形成沉淀,
故答案为:升高温度,减小气体在溶液中的溶解度,利于吹除硫化氢;S;
(3)S2O32-在酸性条件下发生自身氧化还原反应生成二氧化硫和硫单质,反应的离子方程式为S2O32-+2H+=S↓+SO2 ↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2 ↑+H2O;
(4)根据Ksp[Mg(OH)2]=1.8×10-11可知,要使Mg 2+沉淀完全,溶液中c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{1×1{0}^{-5}}}$mol/L=1.34×10-3mol/L,c(H+)=$\frac{1{0}^{-14}}{1.34×1{0}^{-3}}$=7.5×10-12mol/L,则沉淀完全的PH值为12-lg7.5,根据Ksp[Fe(OH)3]=4.0×10-38要使Fe 3+沉淀完全,溶液中c(OH-)=$\root{3}{\frac{4×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=$\root{3}{4×1{0}^{-33}}$mol/L=1.6×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1.6×1{0}^{-11}}$=6.25×10-4mol/L,PH=4-lg6.25,所以当Mg 2+沉淀完全时Fe 3+早已沉淀完全,依据溶度积常数计算镁离子浓度c(Mg2+)$\frac{1.8×1{0}^{-11}}{(\frac{1{0}^{-14}}{1{0}^{-9}})^{2}}$=0.18mol/L,若向0.1mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液发生双水解反应生成氢氧化铁、二氧化碳,现象为产生红褐色沉淀并有气体放出,反应的离子方程式为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑,
故答案为:Fe3+;0.18; 产生红褐色沉淀并有气体放出;2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑;
(5)二氧化硫和氯化钡溶液不发生反应,将足量的SO2气体通入BaCl2溶液中有无明显现象,向NaOH溶液中通入足量的SO2气体反应生成亚硫酸氢钠溶液,亚硫酸氢根离子电离大于水解程度溶液显酸性,溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:无;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查了BaCl2•2H2O制备实验方案的设计方法,题目难度中等,为高考的热点,正确理解制备流程、反应原理为解答关键,涉及知识点较多,有一定的综合性,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

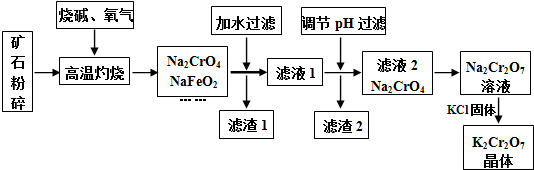
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
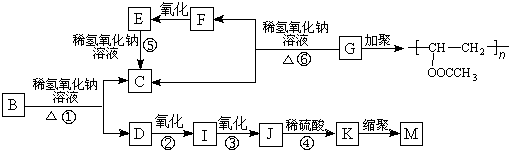
 .
.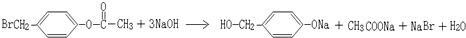 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: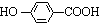 +NaOH→
+NaOH→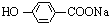 +H2O.
+H2O.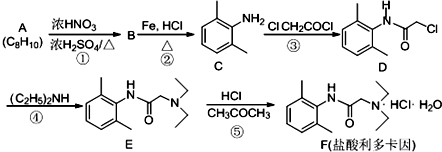
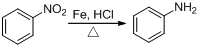
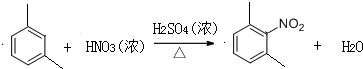 ,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号).
,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号). (R为烃基)
(R为烃基)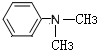 (写结构简式).
(写结构简式).
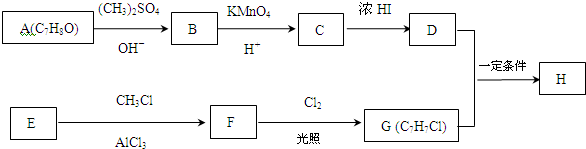
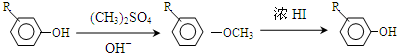

 .
.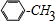 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$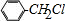 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.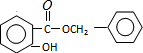 .
. (或
(或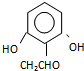 )(任写一种即可)
)(任写一种即可) 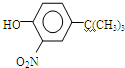
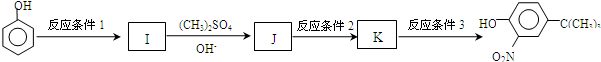
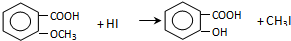
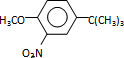 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI. .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.