题目内容
13.有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):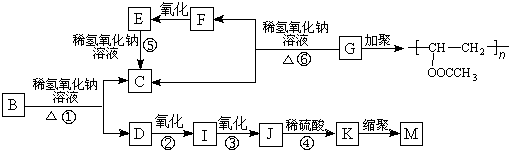
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构.
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH═CHOH→RCH2CHO;②-ONa连在烃基上不会被氧化.
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是银氨溶液(或新制的氢氧化铜悬浊液).
(2)上述变化中属于水解反应的是①⑥(填反应编号).
(3)写出结构简式,G:CH3COOCH=CH2,M:
 .
.(4)写出下列反应的化学方程式:
反应①:
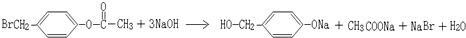 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: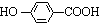 +NaOH→
+NaOH→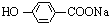 +H2O.
+H2O.(5)同时符合下列要求的A的同分异构体有9种.
I.含有苯环
II.能发生银镜反应和水解反应
III.在稀氢氧化钠溶液中,1mol该同分异构体能与2molNaOH反应.
分析 由G发生加聚反应产物结构式可知,G为CH3COOCH=CH2,G在氢氧化钠水溶液、加热条件下生成F与C,F氧化生成E,E转化得到C,故C为羧酸盐,且F、E、C含有相同的碳原子数目为2,故C结构简式为CH3COONa,F为CH3CHO(CH2=CHOH不稳定),E为CH3COOH.有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,A在光照条件下生成的一溴代物B,B在氢氧化钠水溶液、加热条件下生成C与D,D可以连续氧化生成J,则A含有酯基,J酸化得到K与氯化铁溶液发生显色反应,说明K中含有酚羟基,故A含有苯环,而K中环上的一元取代物只有两种结构,应含有2个不同侧链且处于对位,综上分析可知A为 ,B为
,B为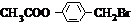 ,D为
,D为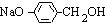 ,I为
,I为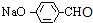 ,J为
,J为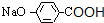 或
或  ,K为
,K为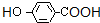 ,M为
,M为 ,据此解答.
,据此解答.
解答 解:由G发生加聚反应产物结构式可知,G为CH3COOCH=CH2,G在氢氧化钠水溶液、加热条件下生成F与C,F氧化生成E,E转化得到C,故C为羧酸盐,且F、E、C含有相同的碳原子数目为2,故C结构简式为CH3COONa,F为CH3CHO(CH2=CHOH不稳定),E为CH3COOH.有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,A在光照条件下生成的一溴代物B,B在氢氧化钠水溶液、加热条件下生成C与D,D可以连续氧化生成J,则A含有酯基,J酸化得到K与氯化铁溶液发生显色反应,说明K中含有酚羟基,故A含有苯环,而K中环上的一元取代物只有两种结构,应含有2个不同侧链且处于对位,综上分析可知A为 ,B为
,B为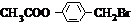 ,D为
,D为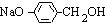 ,I为
,I为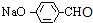 ,J为
,J为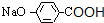 或
或  ,K为
,K为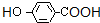 ,M为
,M为 .
.
(1)F为CH3CHO,I为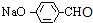 ,均含有醛基,检验该醛基的试剂是:银氨溶液(或新制的氢氧化铜悬浊液),
,均含有醛基,检验该醛基的试剂是:银氨溶液(或新制的氢氧化铜悬浊液),
故答案为:银氨溶液(或新制的氢氧化铜悬浊液);
(2)上述变化中属于水解反应的是:①⑥,故答案为:①⑥;
(3)由上述分析可知,G的结构简式为CH3COOCH=CH2,M的结构简式为 ,
,
故答案为:CH3COOCH=CH2; ;
;
(4)反应①的化学方程式为: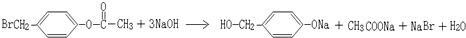 ,
,
K与少量的氢氧化钠溶液反应: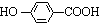 +NaOH→
+NaOH→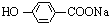 +H2O,
+H2O,
故答案为: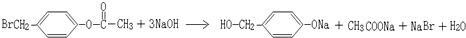 ;
;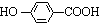 +NaOH→
+NaOH→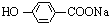 +H2O;
+H2O;
(5)同时符合下列要求的A( )的同分异构体:
)的同分异构体:
I.含有苯环,II.能发生银镜反应和水解反应,含有甲酸形成的酯基,III.在稀氢氧化钠溶液中,1mol该同分异构体能与2molNaOH反应,则其中1个取代基为-OOCH,若另外取代基为-CH2CH3,有邻、间、对3种,若另外取代基为2个-CH3,2个-CH3有邻、间、对3种位置,对应的-OOCH分别有2种、3种、1种位置,故共有9种,
故答案为:9.
点评 本题考查有机物的推断,是对有机物知识的综合运用,需要学生熟练掌握官能团的性质与转化,注意根据G的加聚产物的结构简式与反应条件利用正推法与逆推法结合推断,综合考查学生的分析推理能力,难度中等.

| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
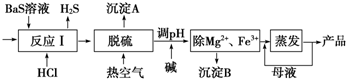
已知:
①浸取时发生的主要反应为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,杂质FeS、CuS、CdS也会发生类似反应.
②某些金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤Ⅰ中浸取时Al2O3与稀硫酸反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(2)步骤Ⅱ中还原回收得到的金属单质是Cu、Cd.
(3)步骤Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,适宜选作物质W的试剂为BD(选填编号).
A.NaOH B.ZnO C.NH3•H2O D.MnCO3
(4)酸性锌锰干电池放电时,负极的电极反应式为Zn-2e-═Zn2+.
(5)MnSO4可用于制备MnCO3,MnCO3在空气中加热反应也可制得MnO2.
已知25℃,101kPa时:
Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1
MnCO3在空气中加热反应生成MnO2的热化学方程式为2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933kJ•mol-1.
(6)按照图示流程,若某次生产过程中使用了100t闪锌矿,其中ZnS含量为80%,浸取时ZnS的损失率为3%,最终得到87t MnO2.假设流程中每个步骤都反应完全,电解(使用惰性电极)时无其他产物生成,则流程中除杂质所引入的锌元素的质量为13t.
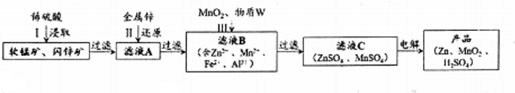
下列说法正确的是( )
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
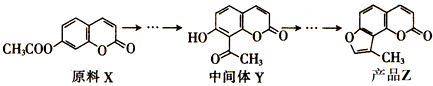
| A. | a电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| B. | 电子流向为a→负载→b→质子交换膜→a | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 当有1mol电子转移时,正极产生2.24L气体 |
| A. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| B. | 一定量的浓硫酸与Xg Zn反应,若转移的电子为0.4 mol,则参加反应的硫酸分子数目一定等于0.4NA | |
| C. | 高温下,16.8g Fe与足量水蒸气反应,转移的电子数为0.7NA | |
| D. | 向含有0.2 mol FeCl3的两份溶液中分别滴加过量Na2S、通入过量H2S气体,则产生的沉淀比为:$\frac{0.3{N}_{A}}{0.1{N}_{A}}$ |
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏高”、“偏低”或“无影响”);
③滴定时边滴边摇动锥形瓶,眼睛应观察B;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为粉红(或浅红)色;
(2)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
 .
.