题目内容
10.X、Y、Z三种物质有如图的转化关系: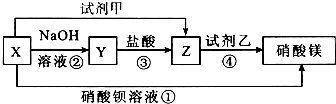
(1)根据上述转化关系,写出下列物质的化学式:
XMgSO4、YMg(OH)2、ZMgCl2,试剂甲BaCl2溶液,试剂乙AgNO3溶液.
(2)写出上述①~④各步反应的离子方程式:
①SO42-+Ba2+═BaSO4↓.②Mg2++2OH-═Mg(OH)2↓.③Mg(OH)2+2H+═Mg2++2H2O.④Ag++Cl-═AgCl↓.
分析 本题的突破点在于反应①,X与Ba(NO3)2溶液反应生成Mg(NO3)2,X中有镁离子,还的会与钡离子生成沉淀,可能含有硫酸根离子或碳酸根离子,而碳酸镁是沉淀,应是MgSO4与Ba(NO3)2生成BaSO4沉淀和Mg(NO3)2,可知X为MgSO4,MgSO4与NaOH溶液反应生成Mg(OH)2沉淀和Na2SO4,其中能继续与盐酸反应的产物是Mg(OH)2,则Y为Mg(OH)2,与盐酸反应生成MgCl2,则Z为MgCl2,MgCl2与AgNO3反应生成Mg(NO3)2和AgCl沉淀,则试剂乙是AgNO3,MgSO4与试剂甲反应生成MgCl2,则试剂甲为BaCl2.
解答 解:(1))本题的突破点在于反应①,X与Ba(NO3)2溶液反应生成Mg(NO3)2,X中有镁离子,还的会与钡离子生成沉淀,可能含有硫酸根离子或碳酸根离子,而碳酸镁是沉淀,应是MgSO4与Ba(NO3)2生成BaSO4沉淀和Mg(NO3)2,可知X为MgSO4,MgSO4与NaOH溶液反应生成Mg(OH)2沉淀和Na2SO4,其中能继续与盐酸反应的产物是Mg(OH)2,则Y为Mg(OH)2,与盐酸反应生成MgCl2,则Z为MgCl2,MgCl2与AgNO3反应生成Mg(NO3)2和AgCl沉淀,则试剂乙是AgNO3,MgSO4与试剂甲反应生成MgCl2,则试剂甲为BaCl2,
故答案为:MgSO4;Mg(OH)2;MgCl2;BaCl2溶液;AgNO3溶液;
(2)反应①的离子方程式为:SO42-+Ba2+═BaSO4↓,
反应②的离子方程式为:Mg2++2OH-═Mg(OH)2↓,
反应③的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O,
反应④的离子方程式为:Ag++Cl-═AgCl↓,
故答案为:SO42-+Ba2+═BaSO4↓;Mg2++2OH-═Mg(OH)2↓;Mg(OH)2+2H+═Mg2++2H2O;Ag++Cl-═AgCl↓.
点评 本题考查无机物推断,关键是根据复分解反应确定X,然再结合转化关系进行推断,最后进行验证即可,熟练掌握元素化合物性质与离子反应.

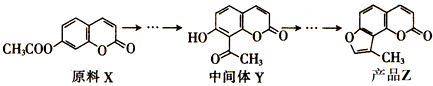
下列说法正确的是( )
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
| A. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| B. | 一定量的浓硫酸与Xg Zn反应,若转移的电子为0.4 mol,则参加反应的硫酸分子数目一定等于0.4NA | |
| C. | 高温下,16.8g Fe与足量水蒸气反应,转移的电子数为0.7NA | |
| D. | 向含有0.2 mol FeCl3的两份溶液中分别滴加过量Na2S、通入过量H2S气体,则产生的沉淀比为:$\frac{0.3{N}_{A}}{0.1{N}_{A}}$ |
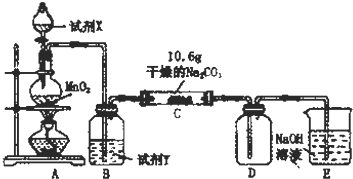
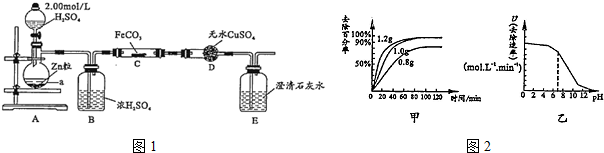
(1)A中制取Cl2的离子方程式4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究.
①提出合理假设.
假设1:存在两种成分:NaHCO3和NaCl;
假设2:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.写出实验步骤以及预期现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
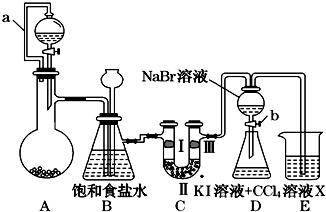
(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O.
(2)本实验目的是制备氯气并探究氯气等物质的相关性质,B装置有几个作用,分别是除去氯气中的氯化氢、作安全瓶,检测实验过程中装置是否堵塞.拆去a导管的后果可能是浓盐酸不能顺利滴入烧瓶.
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是②.
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(5)D装置进行实验时存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,合适的溶液X是①④⑥ (从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择).
 .
.