题目内容
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol过氧化钠与水反应转移电子数为NA |
| B、0.1mol氯化铁水解制成胶体,所得胶体粒子数为0.1NA |
| C、标准状况下,22.4L水中含有水分子数为NA |
| D、1L 0.1mol每升乙酸溶液中氢离子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠中氧元素化合价为-1价,根据1mol过氧化钠完全反应生成的氧气的物质的量计算出转移的电子数;
B.一个胶粒是多个氢氧化铁的聚集体;
C.标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.醋酸为弱电解质,溶液中只能部分电离出氢离子.
B.一个胶粒是多个氢氧化铁的聚集体;
C.标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.醋酸为弱电解质,溶液中只能部分电离出氢离子.
解答:
解:A.1mol过氧化钠与足量的水反应生成0.5mol氧气,转移了1mol电子,反应转移NA个电子,故A正确;
B.一个胶粒是多个氢氧化铁的聚集体,故将0.1 mol FeCl3水解制成胶体,所得胶体粒子数小于0.1NA,故B错误;
C.标况下,水不是气体,题中条件无法计算22.4L水的物质的量,故C错误;
D.,0.1mol醋酸只能部分电离出氢离子,则溶液中氢离子的物质的量小于0.1mol,含有的氢离子数小于0.1NA,故D错误.
故选A.
B.一个胶粒是多个氢氧化铁的聚集体,故将0.1 mol FeCl3水解制成胶体,所得胶体粒子数小于0.1NA,故B错误;
C.标况下,水不是气体,题中条件无法计算22.4L水的物质的量,故C错误;
D.,0.1mol醋酸只能部分电离出氢离子,则溶液中氢离子的物质的量小于0.1mol,含有的氢离子数小于0.1NA,故D错误.
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
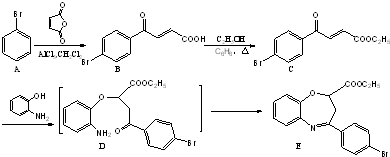
 和一种常见的有机物F,F的结构简式为
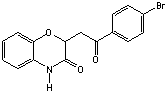
和一种常见的有机物F,F的结构简式为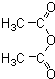
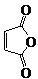 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.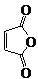 为原料制备化合物
为原料制备化合物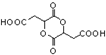 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例: