题目内容
20.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
分析 A.元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定;
B.原子晶体的共价键越强,则硬度越大,熔点越高;
C.结构相似的离子晶体,离子半径越小,晶格能越大;
D.分子间作用力越大,分子的沸点越高.
解答 解:A.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,故A不选;
B.金刚石中键能大于硅中的键能,则金刚石的硬度大,熔点高,与键能有关,故B不选;
C.NaF、NaCl、NaBr、NaI都为离子晶体,离子半径越小,晶格能越大,故C不选;
D.F2、Cl2、Br2、I2的相对分子质量在增大,分子间作用力增大,则熔、沸点在增大,与键能无关,故D选;
故选D.
点评 本题考查键能的大小比较及元素周期律的递变规律,题目难度不大,注意把握晶体类型的判断以及影响晶体熔沸点高低的因素.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.某课外小组对一些金属单质和化合物的性质进行研究.
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应2Al+6H+═2Al3++3H2↑或2Al+3Cu2+═2Al3++3Cu,
化合反应2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是有白色沉淀生成,后沉淀逐渐溶解至消失,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是CuO对H2O2的分解有催化作用.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:水槽(或集气瓶)、导管、量筒、秒表(计时器).
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
置换反应2Al+6H+═2Al3++3H2↑或2Al+3Cu2+═2Al3++3Cu,
化合反应2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是有白色沉淀生成,后沉淀逐渐溶解至消失,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是CuO对H2O2的分解有催化作用.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:水槽(或集气瓶)、导管、量筒、秒表(计时器).
11.下列说法不正确的是( )
| A. | 生活中使用的漂白粉和肥皂都是混合物 | |
| B. | 烟、雾、豆浆、有色玻璃都是胶体 | |
| C. | 汽油属于混合物,而液氯、冰醋酸均属于纯净物 | |
| D. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
8.将某溶液逐滴加入Fe(OH)3胶体内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
15.醋酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |
5.下列有关有机物说法不正确的是( )
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯(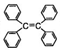 )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol 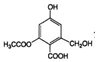 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
12.某化学兴趣小组的同学们对SO2的有关反应进行实验探究:
【实验I】如图1,探究SO2催化氧化的反应:
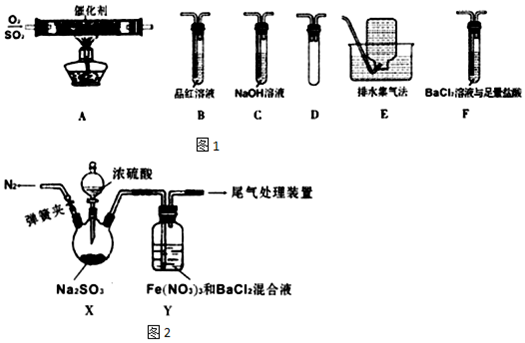
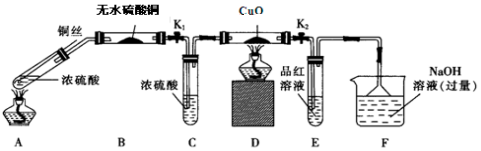
(1)装置 A模拟工业生产中SO2催化氧化的反应,其化学方程式是2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3.
(2)为检验反应后的气体成分,将上图装置依次连接的合理顺序为A、(按气流方向,用字母表示)DFBCE.
(3)能证明气体中有SO2的实验现象是B中品红溶液褪色,有SO3的实验现象是F中有白色沉淀.
【实验II】如图2,探究SO2与Fe(NO3)3,溶液的反应:
(4)X中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气,排除O2的干扰.
(5)装置Y中产生了白色沉淀,其成分是BaSO4;该研究小组对产生白色沉淀的原因进行了假设:
假设1:在酸性条件下SO2与NO3-反应;
假设2:SO2与Fe3+反应;
假设3:SO2与Fe3+、NO3-都反应.
(6)某同学设计实验验证假设1,请帮他完成表中内容.
经验证假设1成立,则验证过程中发生反应的离子方程式是4SO2+NO3-+5H2O+4Ba2+═4BaSO4↓+NH4++6H+(提示:此条件下未见气体产生).
【实验I】如图1,探究SO2催化氧化的反应:

(1)装置 A模拟工业生产中SO2催化氧化的反应,其化学方程式是2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3.
(2)为检验反应后的气体成分,将上图装置依次连接的合理顺序为A、(按气流方向,用字母表示)DFBCE.
(3)能证明气体中有SO2的实验现象是B中品红溶液褪色,有SO3的实验现象是F中有白色沉淀.
【实验II】如图2,探究SO2与Fe(NO3)3,溶液的反应:
(4)X中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气,排除O2的干扰.
(5)装置Y中产生了白色沉淀,其成分是BaSO4;该研究小组对产生白色沉淀的原因进行了假设:
假设1:在酸性条件下SO2与NO3-反应;
假设2:SO2与Fe3+反应;
假设3:SO2与Fe3+、NO3-都反应.
(6)某同学设计实验验证假设1,请帮他完成表中内容.
| 实验步骤 | 现象和结论 |
| ①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的稀硝酸与BaCl2的混合液,并通入适量N2; ③将SO2通入步骤②中溶液. | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立. |
10.一种微生物燃料电池的工作原理如图所示.下列有关该电池的说法错误的是( )

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |