题目内容
15.醋酸的下列性质中,可以证明它是弱电解质的是( )| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质、部分电离的电解质是弱电解质,只要能证明醋酸部分电离,在溶液中存在电离平衡,就能证明醋酸是弱电解质,据此分析解答.
解答 解:A.1mol/L的醋酸溶液中c(H+)=0.01 mol/L,氢离子浓度小于醋酸浓度,说明醋酸部分电离,为弱电解质,故A正确;
B.醋酸与水以任意比例互溶,不能说明醋酸部分电离,则不能证明醋酸是弱电解质,故B错误;
C.10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应,说明醋酸是一元酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故C错误;
D.在相同浓度下,醋酸的导电性比一元强酸溶液的弱,可说明醋酸部分电离,由于没有告诉浓度,则无法判断醋酸是否为弱电解质,故D错误;
故选A.
点评 本题考查弱电解质电离平衡的应用,为高频考点,明确强弱电解质根本区别是解本题关键,浓度未知时不能根据电解质溶液导电性强弱判断电解质强弱,易错选项是B.

练习册系列答案
相关题目
3.对Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质,下列说法正确的是( )
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
10.下列物质分类正确的是( )
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
20.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
7.下列关于SiO2和CO2的叙述不正确的是( )
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
4.某课题组设计实验探究SO2的性质.
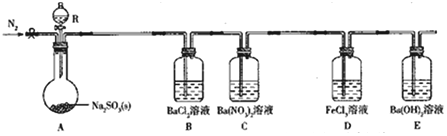
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是分液漏斗.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是排尽装置内空气,避免O2干扰实验.
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2SO42-+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+.
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是c(填字母).
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH<7(填“>”“<”或“=”).

实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是分液漏斗.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是排尽装置内空气,避免O2干扰实验.
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2SO42-+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+.
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH<7(填“>”“<”或“=”).
5.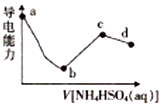 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )| A. | b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡 | |
| B. | c 点滚液中:c(H+)+c(NH4+)=c(NH3•H2O)+c(OH-) | |
| C. | ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-) |