题目内容
9.实验是学习与研究化学的重要方法.Ⅰ.为探究浓硫酸与铜反应,甲组同学按如图装置(固定装置已略去)进行实验:
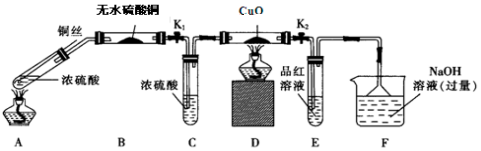
(1)F装置中发生反应的离子方程式是SO2+2OH-=SO32-+H2O;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中品红溶液褪色.
(3)实验结束后,A装置试管液体并不显蓝色,要证明所得产物中是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,溶液变蓝证明产物含铜离子.
Ⅱ.查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,CuO在高温下可分解成Cu2O与O2.乙组同学选用甲组实验中部分装置(装置中试剂可更换)和装有碱石灰的干燥管G,完成制取氨气并还原氧化铜实验.
(4)乙组同学所选装置的连接顺序为A→G→D→F(填装置字母).
(5)乙组同学实验得到红色固体X.对于红色固体X组成,讨论后有如下假设:
①红色固体X是单质Cu;
②红色固体X是Cu2O;
③红色固体X是Cu2O与单质Cu组成的混合物.
乙组同学取少量研碎后红色固体X投入于稀硫酸中充分振荡,现象为:固体部分溶解,溶液变成蓝色.实验证明上述假设①不成立.
(6)乙组同学欲高温燃烧法测定Cu2O的质量分数.称得坩埚的质量为50.0g,取红色固体置于坩埚中称得总质量为70.0g,在空气中高温灼烧至质量恒定后冷却称得最后坩埚与固体总质量为71.6g.
①红色固体中Cu2O的质量分数为36.0%.
②用一个化学方程式表示氨气还原氧化铜:10NH3+18CuO$\frac{\underline{\;\;△\;\;}}{\;}$5N2+3Cu2O+12Cu+15H2O.
分析 (1)F装置吸收二氧化硫气体,生成亚硫酸根和水;
(2)根据C中氧化铜是否被还原及E中品红溶液是否褪色判断;
(3)反应后的混合液中含有浓硫酸,不能向冷却后的溶液中加水,否则会导致液体溅出,应该类比稀释浓硫酸的方法进行操作;
(4)制取氨气并还原氧化铜,用浓氨水制取氨气,干燥生产的氨气,再与氧化铜高温加热反应还原氧化铜,最后吸收氨气,防止污染空气;
(5)根据铜元素单质和氧化物的颜色可知X可能为单质Cu或Cu2O或Cu2O与单质Cu组成的混合物;根据资料:Cu2O溶于稀硫酸生成Cu和CuSO4分析;
(6)①设红色固体中Cu的质量为x,Cu2O的质量为y,根据铜元素质量守恒列式计算;
②根据题意氨气还原氧化铜生成氧化亚铜、铜和氮气.
解答 解:Ⅰ.(1)F装置吸收二氧化硫气体,反应为:SO2+2OH-=SO32-+H2O;
故答案为:SO2+2OH-=SO32-+H2O;
(2)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子;
故答案为:D装置中黑色固体颜色无变化,E中品红溶液褪色;
(3)含有铜离子的溶液显示蓝色,需要将反应后的溶液用水稀释,由于反应后的溶液中含有浓硫酸,所以应该将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,
故答案为:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,溶液变蓝证明产物含铜离子;
Ⅱ.(1)制取氨气并还原氧化铜,选用A装置用浓氨水制取氨气,连接碱石灰的装置G干燥生产的氨气,再与氧化铜高温加热反应还原氧化铜,最后用F装置用酸溶液吸收氨气,防止污染空气,故连接顺序为:A→G→D→F;
故答案为:A→G→D→F;
(2)X可能为单质Cu或Cu2O或Cu2O与单质Cu组成的混合物Cu2O;已知:Cu2O溶于稀硫酸生成Cu和CuSO4,取少量研碎后红色固体X投入于稀硫酸中充分振荡,现象为:固体部分溶解,溶液变成蓝色,说明肯定含有Cu2O,故假设①肯定不成立;
故答案为:Cu2O;①;
(3)①根据题意,原红色固体质量为20g,高温灼烧后的固体质量为21.6g,设红色固体中Cu的质量为x,Cu2O的质量为y,有x+y=20…Ⅰ,Cu高温生CuO,CuO在高温下可分解成Cu2O与O2,故最终的固体全为Cu2O,根据铜元素质量守恒,x的Cu生成的Cu2O质量为:$\frac{144x}{128}$g,则有$\frac{144x}{128}$+y=21.6…Ⅱ,结合Ⅰ和Ⅱ解的x=12.8,y=7.2g,故其中Cu2O的质量分数为$\frac{7.2}{20}×100%$=36.0%;
故答案为:36.0%;
②根据题意氨气还原氧化铜生成氧化亚铜、铜和氮气.花痴反应为:10NH3+18CuO$\frac{\underline{\;\;△\;\;}}{\;}$5N2+3Cu2O+12Cu+15H2O;
故答案为:10NH3+18CuO$\frac{\underline{\;\;△\;\;}}{\;}$5N2+3Cu2O+12Cu+15H2O.
点评 本题考查了探究铜与浓硫酸的反应、铜的氧化物的反应,题目难度中等,涉及浓硫酸与铜反应、二氧化硫的还原性的实验验证、实验探究、产物的检验等知识,II为难点,充分考查了学生的分析、理解能力、数据处理及灵活应用基础知识的能力.

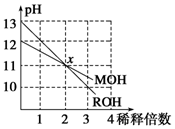 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )| A. | MOH和ROH都是强碱 | |
| B. | 稀释前,ROH=10MOH | |
| C. | 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 | |
| D. | 在x点,M+=R+ |
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
碳酸的电离常数:H2CO3?HCO3-+H+ K1=4.3×10-7
HCO3-?CO32-+H+ K2=5.6×10-12
Mg(OH)2沉淀范围:pH 9.4~12.4
(1)用化学用语解释饱和NaHCO3溶液pH为8.3的原因:HCO3-+H2O?H2CO3+OH-.
(2)实验③中若用CaCl2溶液代替MgCl2溶液完成实验,会观察到白色沉淀.现象不同的原因是溶液中存在平衡HCO3-?CO32-+H+,Ksp(CaCO3)<Ksp(MgCO3),说明Ca2+结合CO32-能力比Mg2+强,所以可以得到CaCO3沉淀.
(3)为探究NaHCO3固体溶解的原理,取实验④反应后的溶液,检验其产物.
Ⅰ.收集反应产生的气体,发现气体能使澄清的石灰水变浑浊.
Ⅱ.测得反应后烧杯中溶液的pH为8.7.
Ⅲ.向反应后的溶液中滴加MgCl2溶液,有白色沉淀生成.
①步骤Ⅲ中白色沉淀是MgCO3.
②结合化学用语解释饱和NaHCO3溶液中固体溶解的原因体系中存在平衡:2HCO3-(aq)?CO32-(aq)+CO2↑+H2O(l).由于CO2不断逸出,平衡正向移动,固体溶解.
③固体全部溶解后溶液pH升高的原因是反应生成了CO32-,由碳酸电离的常数可推出Na2CO3碱性大于NaHCO3,所以溶液pH升高.
(4)实验③的目的是验证检验饱和NaHCO3溶液中CO32-很少,不能与MgCl2溶液产生沉淀.
(5)根据上述实验得出的结论是饱和NaHCO3溶液中可以溶解少量的NaHCO3固体.
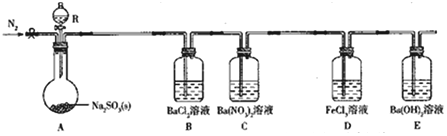
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是分液漏斗.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是排尽装置内空气,避免O2干扰实验.
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2SO42-+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+.
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH<7(填“>”“<”或“=”).
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
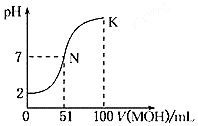 常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | HA的电离方程式为:HA?H++A- | |
| C. | K点溶液中:c (MOH)+c(OH-)-c(H+)=0.01mol•L-1 | |
| D. | N点水的电离程度大于K点水的电离程度 |