题目内容
8.将某溶液逐滴加入Fe(OH)3胶体内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
分析 Fe(OH)3胶体中加入电解质溶液发生聚沉生成Fe(OH)3沉淀,由Fe(OH)3的性质可知,选项中的物质只有盐酸溶液能溶解Fe(OH)3.
解答 解:A.胶体中加氢氧化钠溶液发生聚沉生成Fe(OH)3沉淀,Fe(OH)3不能溶解在氢氧化钠溶液中,故A错误;
B.胶体中加硫酸发生聚沉生成Fe(OH)3沉淀,Fe(OH)3会溶解在硫酸溶液中,故B正确;
C.胶体中加硫酸镁溶液发生聚沉生成Fe(OH)3沉淀,但Fe(OH)3不会溶解在硫酸镁溶液中,故C错误;
D.胶体中加FeCl3溶液发生聚沉生成Fe(OH)3沉淀,Fe(OH)3不会溶解在FeCl3溶液中,故D错误.
故选B.
点评 本题考查了胶体的性质及Fe(OH)3的性质,明确氢氧化铁不溶于水,但能溶解在强酸溶液中是解答本题的关键,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案
相关题目
18.某些高温油炸食品含有丙烯酰胺.过量的丙烯酰胺可引起食品安全问题.关于丙烯酰胺叙述不正确的是( )
| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生加聚反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 能与氢气发生加成反应 |
19.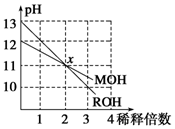 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )| A. | MOH和ROH都是强碱 | |
| B. | 稀释前,ROH=10MOH | |
| C. | 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 | |
| D. | 在x点,M+=R+ |
16.下列各项中表达正确的是( )
| A. | F原子结构示意图: | B. | 次氯酸电子式H Cl O | ||
| C. | H、D、T表示同一种核素 | D. | CO2的结构式为O═C═O |
3.对Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质,下列说法正确的是( )
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
13.M是一种化工原料,可以制备一系列物质(见如图).
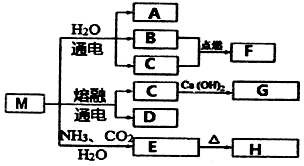
下列说法正确的是( )

下列说法正确的是( )
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |
20.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
17.某研究小组为探究饱和NaHCO3溶液中是否还能溶解少量NaHCO3固体,设计并完成了下列实验.
已知常温下:Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6
碳酸的电离常数:H2CO3?HCO3-+H+ K1=4.3×10-7
HCO3-?CO32-+H+ K2=5.6×10-12
Mg(OH)2沉淀范围:pH 9.4~12.4
(1)用化学用语解释饱和NaHCO3溶液pH为8.3的原因:HCO3-+H2O?H2CO3+OH-.
(2)实验③中若用CaCl2溶液代替MgCl2溶液完成实验,会观察到白色沉淀.现象不同的原因是溶液中存在平衡HCO3-?CO32-+H+,Ksp(CaCO3)<Ksp(MgCO3),说明Ca2+结合CO32-能力比Mg2+强,所以可以得到CaCO3沉淀.
(3)为探究NaHCO3固体溶解的原理,取实验④反应后的溶液,检验其产物.
Ⅰ.收集反应产生的气体,发现气体能使澄清的石灰水变浑浊.
Ⅱ.测得反应后烧杯中溶液的pH为8.7.
Ⅲ.向反应后的溶液中滴加MgCl2溶液,有白色沉淀生成.
①步骤Ⅲ中白色沉淀是MgCO3.
②结合化学用语解释饱和NaHCO3溶液中固体溶解的原因体系中存在平衡:2HCO3-(aq)?CO32-(aq)+CO2↑+H2O(l).由于CO2不断逸出,平衡正向移动,固体溶解.
③固体全部溶解后溶液pH升高的原因是反应生成了CO32-,由碳酸电离的常数可推出Na2CO3碱性大于NaHCO3,所以溶液pH升高.
(4)实验③的目的是验证检验饱和NaHCO3溶液中CO32-很少,不能与MgCl2溶液产生沉淀.
(5)根据上述实验得出的结论是饱和NaHCO3溶液中可以溶解少量的NaHCO3固体.
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
碳酸的电离常数:H2CO3?HCO3-+H+ K1=4.3×10-7
HCO3-?CO32-+H+ K2=5.6×10-12
Mg(OH)2沉淀范围:pH 9.4~12.4
(1)用化学用语解释饱和NaHCO3溶液pH为8.3的原因:HCO3-+H2O?H2CO3+OH-.
(2)实验③中若用CaCl2溶液代替MgCl2溶液完成实验,会观察到白色沉淀.现象不同的原因是溶液中存在平衡HCO3-?CO32-+H+,Ksp(CaCO3)<Ksp(MgCO3),说明Ca2+结合CO32-能力比Mg2+强,所以可以得到CaCO3沉淀.
(3)为探究NaHCO3固体溶解的原理,取实验④反应后的溶液,检验其产物.
Ⅰ.收集反应产生的气体,发现气体能使澄清的石灰水变浑浊.
Ⅱ.测得反应后烧杯中溶液的pH为8.7.
Ⅲ.向反应后的溶液中滴加MgCl2溶液,有白色沉淀生成.
①步骤Ⅲ中白色沉淀是MgCO3.
②结合化学用语解释饱和NaHCO3溶液中固体溶解的原因体系中存在平衡:2HCO3-(aq)?CO32-(aq)+CO2↑+H2O(l).由于CO2不断逸出,平衡正向移动,固体溶解.
③固体全部溶解后溶液pH升高的原因是反应生成了CO32-,由碳酸电离的常数可推出Na2CO3碱性大于NaHCO3,所以溶液pH升高.
(4)实验③的目的是验证检验饱和NaHCO3溶液中CO32-很少,不能与MgCl2溶液产生沉淀.
(5)根据上述实验得出的结论是饱和NaHCO3溶液中可以溶解少量的NaHCO3固体.