题目内容
19.下列关于醋酸钠溶液的说法中正确的是( )| A. | 溶液呈酸性 | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 CH3COONa是强碱弱酸盐,水解显碱性.CH3COONa在溶液中的行为:CH3COONa=CH3COO-+Na+
CH3COO-+H2O?CH3COOH+OH-
H2O?H++OH-
根据电荷守恒来分析.
解答 解:CH3COONa在溶液中的行为:CH3COONa=CH3COO-+Na+
CH3COO-+H2O?CH3COOH+OH-
H2O?H++OH-
A、CH3COONa是强碱弱酸盐,水解显碱性,故A错误;
B、CH3COONa溶液中的离子有四种:H+、Na+、CH3COO-、OH-,根据电荷守恒可有:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),故B错误;
C、由于溶液水解显碱性,故c(OH-)>c(H+),而CH3COO-是弱酸根,在溶液中会水解,故c(Na+)>c(CH3COO-),故离子浓度大小关系有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确,则D错误.
故选C.
点评 本题考查了盐的水解的酸碱性和盐溶液中的电荷守恒的应用以及离子浓度的大小比较,难度不大,注意基础的掌握.

练习册系列答案
相关题目
10.下列物质既能通过化合反应,又能通过复分解反应生成的是( )
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
| A. | ④除外都可以 | B. | 除②④外都可以 | C. | 只有①⑤⑥可以 | D. | 全部都可以 |
7.下列反应中,HCl作为氧化剂的是( )
| A. | HCl+AgNO3═HNO3+AgCl↓ | B. | Mg+2HCl═MgCl2+H2↑ | ||
| C. | MnO2+4HCl═MnCl2+Cl2↑+2H2O | D. | Au+HNO3+4HCl═HAuCl4+NO↑+2H2O |
14.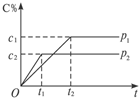 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )| A. | p1>p2 | B. | 反应吸热 | C. | m+n>p+q | D. | m+n<p+q |
11.用NA表示阿伏加德罗常数值.下列叙述正确的是( )
| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为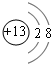 .
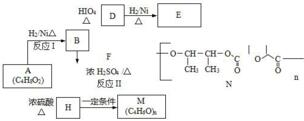
.
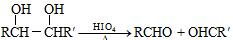
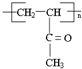 .
.