题目内容
19.①高锰酸钾和浓盐酸可以发生如下反应:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O,在该反应中,氧化剂是KMnO4.
②标出上述方程式电子转移的方向与数目(用双线桥法)
 .
.
分析 ①氧化剂化合价降低;
②根据反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,生成MnCl2为还原产物,
16HCl中有10HCl的Cl化合价由-1升高到0价,转移电子数为10mol来标电子转移情况.
解答 解:①反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,故答案为:KMnO4;
②反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,16HCl中有10HCl的Cl化合价由-1升高到0价,则转移电子数为10mol,所以双线桥表示为: ,
,
故答案为: .
.
点评 本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.常温下,体积相同、物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液pH分别为7、9、10,则下列说法不正确的是( )
| A. | 酸性强弱HX>HY>HZ | B. | 有两种盐能发生水解 | ||
| C. | 分别稀释上述三种溶液,pH均变小 | D. | 三种溶液中离子总数不相同 |
14.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是9NA | |
| B. | 7.8g 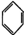 中含有的碳碳双键数为0.3NA 中含有的碳碳双键数为0.3NA | |
| C. | 1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA | |
| D. | 标准状况下,11.2L己烷所含分子数为0.5NA |
4.现有以下物质:①NaCl晶体②液态HCl③CaCO3固体④熔融KCl⑤蔗糖⑥铜⑦CO2⑧H2SO4⑨KOH固体⑩浓盐酸.下列说法正确的是( )
| A. | 以上物质能导电的是④⑥⑩ | |
| B. | 以上物质属于电解质的是①②③④⑧⑨⑩ | |
| C. | 属于非电解质的是②⑤⑦ | |
| D. | 以上物质中,溶于水能够导电的物质是①②④⑤⑦⑧⑩ |
11.下列表示物质结构的化学用语或模型正确的是( )
| A. | 硫酸的电离方程式:H2SO4=H2++SO42- | |
| B. | CO2的电子式: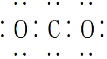 | |
| C. | Cl-离子的结构示意图: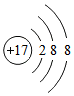 | |
| D. | 苯的结构简式:C6H6 |
8.向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
| A. | KI和NaBr | B. | KCl和NaCl | C. | KCl和NaBr | D. | KCl、NaCl和I2 |
