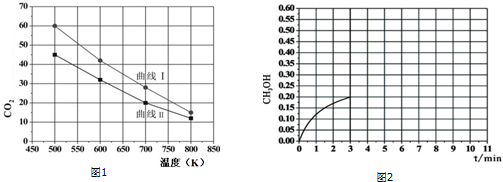
题目内容
6.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下: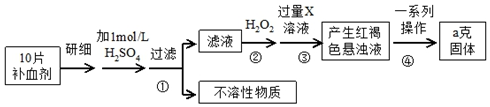
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸),该过程的现象为:溶液开始不变色,后变为血红色.
(2)步骤②加入过量H2O2的目的:将Fe2+全部氧化为Fe3+.
(3)步骤③中反应的离子方程式:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+.
(4)若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需250mL容量瓶.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是b.
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为紫或紫红色.若滴定到终点时俯视滴定管刻度线,对测量值有何影响?偏低( 填“偏高、偏低或无影响”).
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显血红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,铁离子和氨水反应生成氢氧化铁和铵根离子;
(4)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
②加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果;
③用高锰酸钾溶液滴定亚铁离子时,滴定到终点时溶液会出现紫色或紫红色,若滴定到终点时俯视滴定管刻度线,则读出的高锰酸钾溶液的体积偏小,据此判断.
解答 解:(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-?Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,可以加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,故答案为:0.07a;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
②高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,故答案为:b;
③用高锰酸钾溶液滴定亚铁离子时,滴定到终点时溶液会出现紫色或紫红色,若滴定到终点时俯视滴定管刻度线,则读出的高锰酸钾溶液的体积偏小,所以会使测量值偏低,
故答案为:紫或紫红;偏低.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
I.已知该产业链中某反应的平衡表达式为:K=$\frac{{c({H_2})•c({CO})}}{{c({H_2}O)}}$,它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g);
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=5.4mol/L.
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
②平衡时二甲醚的物质的量浓度是1.6mol/L.
| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
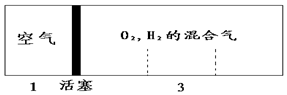 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )