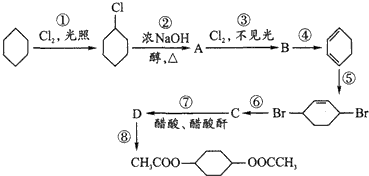
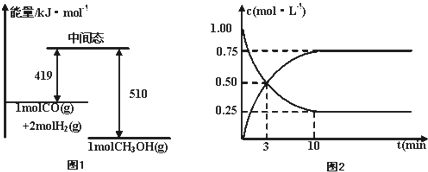
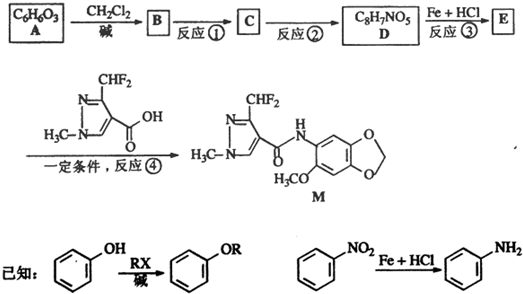
题目内容
使CO2在一定条件下发生分解反应:2CO2=2CO+O2,在某一时刻测得混合气体对氢气的相对密度为20,则,此时CO2的分解了 %.
考点:化学方程式的有关计算
专题:计算题
分析:令二氧化碳为2mol,根据反应后混合气体的密度计算平均摩尔质量,根据质量守恒计算混合气体总质量,再根据n=
计算混合气体总物质的量,根据差量法计算发生分解的二氧化碳的物质的量,进而计算二氧化碳的分解率.
| m |
| M |
解答:
解:混合气体对氢气的相对密度为20,则混合气体的平均摩尔质量=20×2g/mol=40g/mol,
二氧化碳为2mol,根据质量守恒,则混合气体总质量=2mol×44g/mol=88g,故混合气体总物质的量=
=2.2mol,
2CO2=2CO+O2 物质的量增大
2 1
n(CO2) 2.2mol-2mol=0.2mol
故n(CO2)=
=0.4mol
故该时刻二氧化碳的分解率=
×100%=20%,
故答案为:20.
二氧化碳为2mol,根据质量守恒,则混合气体总质量=2mol×44g/mol=88g,故混合气体总物质的量=
| 88g |
| 40g/mol |
2CO2=2CO+O2 物质的量增大
2 1
n(CO2) 2.2mol-2mol=0.2mol
故n(CO2)=
| 2×0.2mol |
| 1 |
故该时刻二氧化碳的分解率=
| 0.4mol |
| 2mol |
故答案为:20.
点评:本题考查根据方程式的计算,注意利用赋值法进行计算,难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列各物质n(n≥3、自然数)相同时,其同类物质的同分异构体最多的是( )
| A、CnH2n+2O 醇 |
| B、CnH2nO 醛 |
| C、CnH2nO2 酸 |
| D、CnH2n+2 烃 |