题目内容
0.2mol某有机物和0.4mol O2在密闭容器中燃烧后,反应物无剩余,产物为CO2、CO和H2O的混合物.现将产物先通过浓H2SO4,发现浓H2SO4增重10.8g;接着经过灼热的CuO充分反应后,发现CuO失重3.2g;最后通过碱石灰,发现碱石灰增重17.6g.若已知0.2mol该有机物与0.4mol钠恰好反应,请同学们计算并回答:
(1)写出有机物的分子式.
(2)写出该有机物稳定的结构简式.(注意:同一个碳上连有两个羟基是不稳定的)
(1)写出有机物的分子式.
(2)写出该有机物稳定的结构简式.(注意:同一个碳上连有两个羟基是不稳定的)
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)浓硫酸具有吸水性,产物质量减轻10.8g,说明反应产物中含水10.8g,通过灼热氧化铜,由于发生反应CuO+CO
Cu+CO2,产物质量增加了3.2g,结合方程式利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了17.6g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式.
(2)结合分子式、与钠反应的物质的量确定官能团种类及数目,据此书写结构简式.
| ||
(2)结合分子式、与钠反应的物质的量确定官能团种类及数目,据此书写结构简式.
解答:
解:(1)有机物燃烧生成水10.8g,水的物质的量为:
=0.6mol,
设有机物燃烧生成的CO质量为x,
则:CuO+CO
Cu+CO2,气态增重△m
28g 16g
x 3.2g
所以x=
=5.6g,CO的物质的量为:
=0.2mol,
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为:0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为:17.6g-8.8g=8.8g,物质的量为:
=0.2mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为:
mol=2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:
mol=6mol
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:
=2mol.
所以有机物的分子式为:C2H6O2,
答:有机物的分子式为C2H6O2;
(2)若已知0.2mol该有机物与0.4mol钠恰好反应,有机物中含有2个羟基,该有机物的结构简式为 ,
,
答:该有机物的结构简式为 .
.
| 10.8g |
| 18g/mol |
设有机物燃烧生成的CO质量为x,
则:CuO+CO
| ||
28g 16g
x 3.2g
所以x=
| 28g×3.2g |
| 16g |
| 5.6g |
| 28g/mol |
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为:0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为:17.6g-8.8g=8.8g,物质的量为:
| 8.8g |
| 44g/mol |
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为:
| 0.2mol+0.2mol |
| 0.2mol |
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:
| 0.6mol×2 |
| 0.2 |
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:
| 0.6mol+0.2mol+0.2mol×2-0.4mol×2 |
| 0.2 |
所以有机物的分子式为:C2H6O2,
答:有机物的分子式为C2H6O2;
(2)若已知0.2mol该有机物与0.4mol钠恰好反应,有机物中含有2个羟基,该有机物的结构简式为
 ,
,答:该有机物的结构简式为
 .
.
点评:本题考查了常见有机物分子式、结构简式的确定的计算,题目难度中等,注意掌握确定有机物分子式、结构式的方法,能够根据反应现象判断有机物分子中含有的官能团类型及数目是解答本题的关键.

练习册系列答案
相关题目
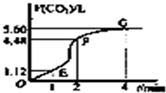 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题: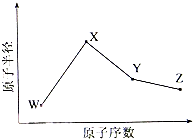 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大. 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题: