题目内容
Ⅰ.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母).
a.容器中压强不变
b.1molH-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)一定条件下,利用CO和H2反应可制得甲醇:CO+2H2?CH3OH.图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.
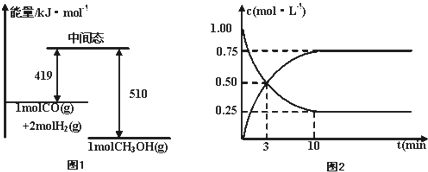
①根据上图1,写出在该条件下CO制备甲醇的热化学方程式 .
②根据上图2计算该温度下反应CO(g)+2H2(g)?CH3OH(g)的平衡常数 .
Ⅱ.25℃时,水的离子积常数KW= ;
(1)该温度下,0.01mol?L-1的NaOH溶液的pH= ;
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.则:
①pH=a的NaOH溶液的c(OH-)= ;
②pH=b的硫酸的c(H2SO4)= ;
③若所得混合液为中性,且a=12,b=2,则Va:Vb= ;
④若所得混合液为中性,且a+b=13,则Va:Vb= .
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中压强不变
b.1molH-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)一定条件下,利用CO和H2反应可制得甲醇:CO+2H2?CH3OH.图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.

①根据上图1,写出在该条件下CO制备甲醇的热化学方程式
②根据上图2计算该温度下反应CO(g)+2H2(g)?CH3OH(g)的平衡常数
Ⅱ.25℃时,水的离子积常数KW=
(1)该温度下,0.01mol?L-1的NaOH溶液的pH=
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.则:
①pH=a的NaOH溶液的c(OH-)=
②pH=b的硫酸的c(H2SO4)=
③若所得混合液为中性,且a=12,b=2,则Va:Vb=
④若所得混合液为中性,且a+b=13,则Va:Vb=
考点:化学平衡状态的判断,反应热和焓变,酸碱混合时的定性判断及有关ph的计算
专题:基本概念与基本理论
分析:Ⅰ、(1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断;
(2)依据图象1结合热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(3)计算出平衡时各物质的平衡浓度,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可求得平衡常数;
Ⅱ、常温下水的离子积常数为10-14;
(1)根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
(2)将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,
①根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
②根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
若所得混合溶液为中性,且a=12,b=2,根据c(OH-)×Va=c(H+)×Vb计算;
②若所得混合溶液的pH=10,碱过量,计算出c(OH-)与酸碱的物质的量的关系,可计算.
(2)依据图象1结合热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(3)计算出平衡时各物质的平衡浓度,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可求得平衡常数;
Ⅱ、常温下水的离子积常数为10-14;
(1)根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
(2)将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,
①根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
②根据Kw=c(H+)×c(OH-)计算c(H+)得到溶液PH;
若所得混合溶液为中性,且a=12,b=2,根据c(OH-)×Va=c(H+)×Vb计算;
②若所得混合溶液的pH=10,碱过量,计算出c(OH-)与酸碱的物质的量的关系,可计算.
解答:
解:Ⅰ、(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,反应是气体体积增大的吸热反应,
a.一定温度下,在一个容积可变的密闭容器中发生上述反应,反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,压强增大,保持恒压,容器中的压强始终不变,不能说明反应到达平衡,故a错误;
b.1 molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确.
c.反应速率之比等于化学方程式计量数之比,v正(CO)=v逆(H2O),说明水的正反应速率和逆反应速率相同,反应达到平衡状态,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选:bc;
(2)根据上图1在该条件下CO制备甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91KJ/mol;
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91KJ/mol;
(3)根据平衡时CO的浓度为0.25mol/L可知,反应消耗的H2物质的量为2×2L×0.75mol/L=3mol,则平衡时H2的物质的量浓度为0.5mol/L,甲醇平衡浓度=0.75mol/L,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,K=
=12L2/mol2;
故答案为:12L2/mol2;
Ⅱ、25℃时,水的离子积常数KW=1×10-14;
故答案为:1×10-14 ;
(1)该温度下,0.01mol?L-1的NaOH溶液中,c(H+)=
=10-12mol/L,的pH=-lg10-12=12;
故答案为:12;
(2)将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,
①pH=a的NaOH溶液中,c(OH-)=
=10a-14mol/L;
故答案为:10a-14mol/L;
②pH=b的硫酸中c(H+)=10-bmol/L,的c(H2SO4)=
×10-bmol/L=
mol/L;
故答案为:
mol/L;
③若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=12,b=2,则0.01×Va=0.01Vb,则Va:Vb=1:1,故答案为:1:1;
②若所得混合液为中性,且a+b=13,依据酸碱恰好反应的定量关系计算,10a-14mol/L×Va=10-bmol/L×Vb,则Va:Vb=1014-a-b=10;
故答案为:10:1.
a.一定温度下,在一个容积可变的密闭容器中发生上述反应,反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,压强增大,保持恒压,容器中的压强始终不变,不能说明反应到达平衡,故a错误;
b.1 molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确.
c.反应速率之比等于化学方程式计量数之比,v正(CO)=v逆(H2O),说明水的正反应速率和逆反应速率相同,反应达到平衡状态,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选:bc;
(2)根据上图1在该条件下CO制备甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91KJ/mol;
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91KJ/mol;
(3)根据平衡时CO的浓度为0.25mol/L可知,反应消耗的H2物质的量为2×2L×0.75mol/L=3mol,则平衡时H2的物质的量浓度为0.5mol/L,甲醇平衡浓度=0.75mol/L,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,K=
| 0.75 |
| 0.25×0.52 |
故答案为:12L2/mol2;
Ⅱ、25℃时,水的离子积常数KW=1×10-14;
故答案为:1×10-14 ;
(1)该温度下,0.01mol?L-1的NaOH溶液中,c(H+)=
| 10-14 |
| 0.01mol/L |
故答案为:12;
(2)将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,
①pH=a的NaOH溶液中,c(OH-)=
| 10-14 |
| 10-a |
故答案为:10a-14mol/L;
②pH=b的硫酸中c(H+)=10-bmol/L,的c(H2SO4)=
| 1 |
| 2 |
| 10-b |
| 2 |
故答案为:
| 10-b |
| 2 |
③若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=12,b=2,则0.01×Va=0.01Vb,则Va:Vb=1:1,故答案为:1:1;
②若所得混合液为中性,且a+b=13,依据酸碱恰好反应的定量关系计算,10a-14mol/L×Va=10-bmol/L×Vb,则Va:Vb=1014-a-b=10;
故答案为:10:1.
点评:本题考查化学平衡移动以及平衡常数、酸碱混合的计算,题目难度中等,本题注意热化学方程式的书写,综合考查学生的计算能力和分析能力,注意把握相关计算公式.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
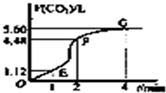 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题: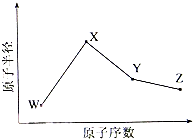 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大. 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题: