题目内容
4.49g H2SO4的物质的量是0.5mol;O原子的个数是2NA;1.5mol H2SO4的质量是147,其中含有3mol H,含有96g O.分析 结合m=nM、N=nNA及分子构成计算.
解答 解:49g H2SO4的物质的量是$\frac{49g}{98g/mol}$=0.5mol;O原子的个数是0.5mol×4×NA=2NA个;1.5mol H2SO4的质量是1.5mol×98g/mol=147g,其中含有1.5mol×2=3mol H,含有1.5mol×4×16g/mol=96g O,
故答案为:0.5mol;2NA;147;3;96.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成及基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
15.短周期主族元素W、X、Y、Z的原子序数依次递增.其中W、X的简单离子具有相同的电子层结构,且简单离子所带电荷绝对值相同;W与Y同主族.且Y的单质存在于火山口附近.下列说法正确的是( )
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
12.下列关于碳氢化合物的说法正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 燃烧产物为CO2和H2O的化合物一定是碳氢化合物 | |
| C. | 碳原子间以单键相连的烃是烷烃 | |
| D. | 烷烃分子的相对分子质量一定是偶数 |
19.关于下列装置用途的判断正确的是( )
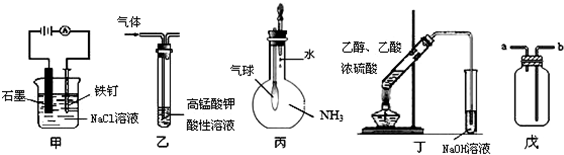
①装置甲可防止铁钉被腐蚀
②装置乙可除去甲醛中混有的乙烯
③装置丙可检验 NH3气体在水中的溶解性④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集 H2、CO2、Cl2、HCl、NO2等气体.

①装置甲可防止铁钉被腐蚀
②装置乙可除去甲醛中混有的乙烯
③装置丙可检验 NH3气体在水中的溶解性④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集 H2、CO2、Cl2、HCl、NO2等气体.
| A. | 只有③④ | B. | 只有③⑤ | C. | 只有①③⑤ | D. | 只有①②④ |
9.下列说法正确的是( )
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
17.现有部分短周期元素的性质或原子结构如表:
(1)C在周期表中的位置第二周期VA族;C的氢化物水溶液呈碱性(填“酸”、“碱”或“中”),其原因NH3.H2O?NH4++OH-(用离子方程式表达).
(2)E原子的电子式为 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为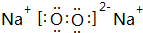 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
(2)E原子的电子式为
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为
 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.  写出同时符合下列条件的同分异构体:
写出同时符合下列条件的同分异构体:
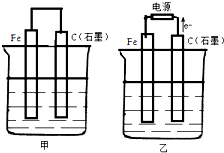 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.