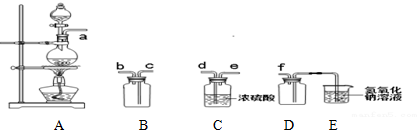
题目内容
8.A、B、C、D、E五种短周期元素其原子序数依次增大.B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物.请回答:(1)写出元素的符号:AH;BC;CN;ENa.
(2)画出D的原子结构示意图
 .
.(3)E与D形成X2Y型化合物的电子式是
 .
.
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D(氧)都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,据此进行解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D(氧)都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,
(1)由上述分析可知,A为H元素,B为C元素,C为N元素,E为Na,
故答案为:H;C;N;Na;
(2)D为O元素,其原子序数为8,氧原子的原子结构示意图为: ,
,
故答案为: ;
;
(3)E、D分别为Na、O元素,二者形成X2Y型化合物为Na2O,氧化钠为离子化合物,其电子式为 ,
,
故答案为: .
.
点评 本题考查了无机物推断,题目难度中等,根据物质之间的反应、物质的性质等知识点确定物质,再结合物质的结构分析解答,同时考查学生分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.短周期主族元素W、X、Y、Z的原子序数依次递增.其中W、X的简单离子具有相同的电子层结构,且简单离子所带电荷绝对值相同;W与Y同主族.且Y的单质存在于火山口附近.下列说法正确的是( )
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
13.下列实验现象预测错误的是( )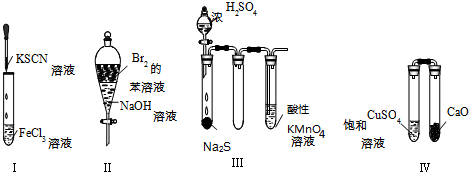

| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
17.现有部分短周期元素的性质或原子结构如表:
(1)C在周期表中的位置第二周期VA族;C的氢化物水溶液呈碱性(填“酸”、“碱”或“中”),其原因NH3.H2O?NH4++OH-(用离子方程式表达).
(2)E原子的电子式为 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为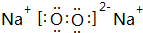 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
(2)E原子的电子式为
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为
 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
18.下列叙述不正确的是( )
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
 写出同时符合下列条件的同分异构体:
写出同时符合下列条件的同分异构体:
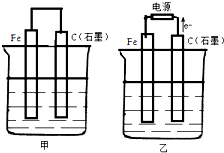 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.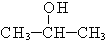 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O,产物不发生银镜反应;
+2H2O,产物不发生银镜反应; +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$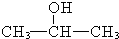 .
.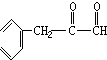 ,G与M是由不同方式形成的高分子化合物.
,G与M是由不同方式形成的高分子化合物.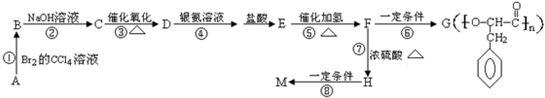
 .
. ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.
 ,
, .
.