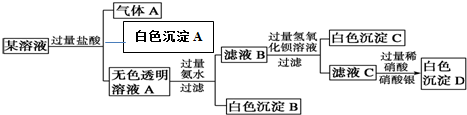
题目内容
9.下列有关说法中正确的是( )| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
分析 A.25℃时NH4CN溶液显碱性,则阴离子水解程度大于阳离子水解程度;
B.由水电离出的c(H+)=10-12mol•L-1的溶液,可能显酸性也可能显碱性;
C.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L,c(Ag+)越小,先生成沉淀;
D.根据电荷守恒分析.
解答 解:A.25℃时NH4CN溶液显碱性,由于铵根离子水解显酸性,CN-水解显碱性,所以阴离子水解程度大于阳离子水解程度,水解程度越大,其酸或碱的电离常数越小,所以K(NH3•H2O)>K(HCN),故A正确;
B.由水电离出的c(H+)=10-12mol•L-1的溶液,可能显酸性也可能显碱性,所以HCO3-不能大量存在,故B错误;
C.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L,c(Ag+)越小,先生成沉淀,所以Cl-先生成沉淀,故C错误;
D.常温下pH=7的CH3COOH和NaOH混合溶液中,电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液显中性,则c(H+)=c(OH-),则c(Na+)=c(CH3COO-),故D错误.
故选A.
点评 本题考查较综合,涉及盐的水解原理、离子共存及离子浓度比较、溶度积常数的计算等,把握发生的反应、电离与水解的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
(2)E原子的电子式为
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为
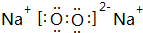 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+. | A. | 规格 | B. | 温度 | C. | 刻度线 | D. | 物质的量浓度 |
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
 写出同时符合下列条件的同分异构体:
写出同时符合下列条件的同分异构体:
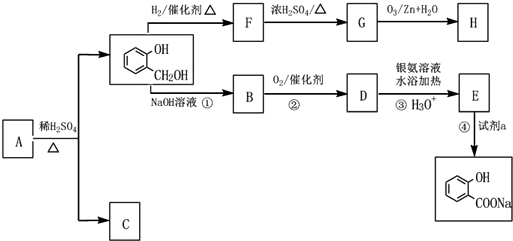
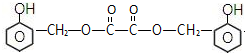 ,C俗称为草酸;
,C俗称为草酸;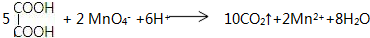 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: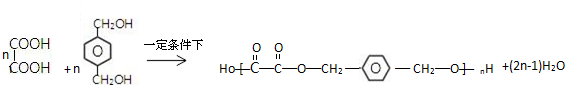 ;
; ;
;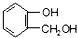 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;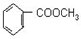 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下: