题目内容
12.下列说法正确的是( )| A. | 减小反应物浓度,可减小反应物分子中的活化分子百分数,使有效碰撞次数减小 | |
| B. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| C. | 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率增大 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
分析 A.减小反应物浓度,活化分子百分数不变;
B.升高温度可增大活化分子的百分数;
C.增大压强活化分子的百分数不变;
D.催化剂降低反应物的活化能.
解答 解:A.减小反应物浓度,活化分子百分数不变,但单位体积活化分子数目减小,效碰撞次数减小,故A错误;
B.升高温度可增大活化分子的百分数,效碰撞次数增多,反应速率增大,故B正确;
C.增大压强活化分子的百分数不变,故C错误;
D.使用催化剂,改变反应的历程,使反应的活化能降低,则反应速率加快,反应的始终态不变,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
3.下列实验操作和数据记录都正确的是( )
| A. | 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2g | |
| B. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| C. | 用干燥的广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10mL量筒量取NaCl溶液,体积为9.2mL |
20.下列与有机物结构、性质相关的叙述中,正确的是( )
| A. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的变化过程,上述两个反应属于水解反应 | |
| B. | 丹参素结构如图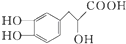 所示,能发生取代、加成、氧化反应 所示,能发生取代、加成、氧化反应 | |
| C. | 乙烯含双键,可使酸性KMnO4溶液褪色,而乙醇中只含单键不能使酸性高锰酸钾溶液褪色 | |
| D. | 回收地沟油,水解制氨基酸 |
17.下列除杂(括号内为杂质)的方法不正确的是( )
| A. | 镁粉(铝粉):加入过量烧碱溶液,过滤 | |
| B. | FeCl3溶液(FeCl2):加入适量的稀硝酸 | |
| C. | CuO(Al2O3):加入过量烧碱溶液,过滤 | |
| D. | CO2(HCl):通过饱和碳酸氢钠溶液,洗气 |
4.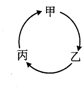 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
( )
 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是| 选项、物质 | 甲 | 乙 | 丙 |
| A | SO2 | SO3 | H2SO4 |
| B | NH4Cl | NH3 | NO |
| C | Na | NaOH | NaCl |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
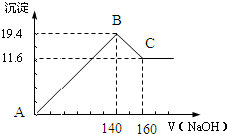
1.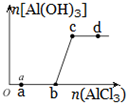 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
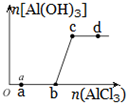 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )| A. | a点对应的溶液中加入MgCl2无明显现象 | |
| B. | b点对应的溶液是NaAlO2溶液 | |
| C. | c点对应的溶液中c(Na+)=c(Cl-) | |
| D. | d点对应的溶液呈酸性 |
2. 保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
①氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和-COOH(写结构简式).
②发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
③如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
结合试管1、2中的现象,得出的结论是这两支试管中淀粉没有水解(填“没有”“部分”或“全部”).结合试管3、4中的现象,不能得出“这两支试管中淀粉没有水解”的结论,理由是银镜反应须在碱性环境中进行,未用NaOH溶液中和硫酸.
 保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.①氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和-COOH(写结构简式).
②发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
③如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
| 编号 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |