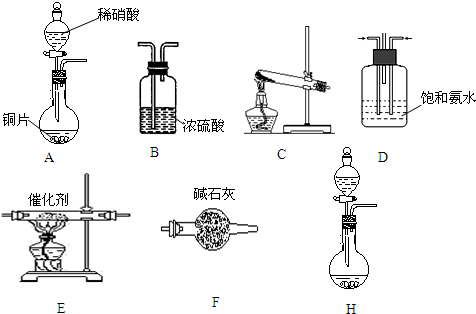
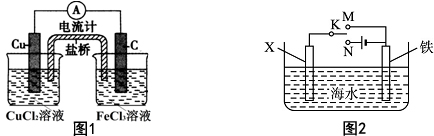题目内容
17.下列除杂(括号内为杂质)的方法不正确的是( )| A. | 镁粉(铝粉):加入过量烧碱溶液,过滤 | |
| B. | FeCl3溶液(FeCl2):加入适量的稀硝酸 | |
| C. | CuO(Al2O3):加入过量烧碱溶液,过滤 | |
| D. | CO2(HCl):通过饱和碳酸氢钠溶液,洗气 |
分析 A.Al与NaOH溶液反应,而Mg不能;
B.亚铁离子被硝酸氧化,引入硝酸根离子;
C.氧化铝与烧碱反应,而CuO不能;
D.HCl与饱和碳酸氢钠反应生成二氧化碳.
解答 解:A.Al与NaOH溶液反应,而Mg不能,则加入过量烧碱溶液,过滤可除杂,故A正确;
B.亚铁离子被硝酸氧化,引入硝酸根离子,不符合除杂的原则,应选氯气除杂,故B错误;
C.氧化铝与烧碱反应,而CuO不能,则加入过量烧碱溶液,过滤可除杂,故C正确;
D.HCl与饱和碳酸氢钠反应生成二氧化碳,则通过饱和碳酸氢钠溶液,洗气可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物的综合应用,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 减小反应物浓度,可减小反应物分子中的活化分子百分数,使有效碰撞次数减小 | |
| B. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| C. | 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率增大 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
2.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )(已知Na2O与水反应生成NaOH)
①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
9.下列设计的实验方案能达到实验目的是( )
| A. | 检验淀粉是否完全水解:取少量水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,看是否有砖红色沉淀生成 | |
| B. | 提纯混有少量CaCl2的NaCl固体:将固体配成溶液,加入稍过量Na2CO3溶液至沉淀完全,过滤,再向滤液中加入稍过量盐酸,蒸发结晶 | |
| C. | 制取少量乙酸乙酯:向试管中加入浓硫酸,再加入无水乙醇,冷却后加入冰醋酸,加热,将生成的蒸气导至盛有氢氧化钠溶液的试管中 | |
| D. | 验证炭与浓硫酸反应产生的CO2:将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
6.在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质.
图中:
①为氯气发生装置;
②的试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
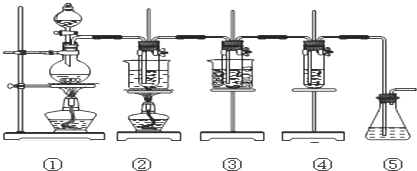
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”或“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的物质的量为0.4mol.
(3)写出装置②中发生反应的化学方程式3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
图中:
①为氯气发生装置;
②的试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:

(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”或“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的物质的量为0.4mol.
(3)写出装置②中发生反应的化学方程式3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |