题目内容
5.A、B、C、D、E是短周期中原子序数依次增大的主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.常温常压下,E单质是淡黄色固体,常在火山口附近沉积.(1)CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(2)B 元素的元素符号:C;CA的电子式为
 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.(3)A2E的燃烧热△H=-a kJ•mol-1,写出A2E燃烧反应的热化学方程式:H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g)△H=-aKJ/mol.
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同.回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式4H++AlO2-=Al3++2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓.
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(SO42-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)>c(CO32-).
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:Al+3HCO3--3e-=Al(OH)3+3CO2↑;由R生成Q的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 A、B、C、D、E是短周期中原子序数依次增大的主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S.元素C在同周期的主族元素中原子半径最大,则C处于IA族,元素B的原子最外层电子数是其电子层数的2倍,B原子只能有2个电子层,最外层电子数为4,故B为碳元素,可推知C为Na;元素A的单质在常温下呈气态,则A为H元素.
(1)CA为NaH,和水反应生成氢氧化钠和氢气;
(2)CA为NaH,由钠离子与氢负离子构成;铝元素在周期表中位于第三周期ⅢA族;
(3)硫化氢的燃烧热表示为1摩尔硫化氢完全燃烧生成液态水和二氧化硫气体时放出aKJ的热量;
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,甲为碳酸钠,乙为偏铝酸钠,丙为硫酸氢钠.
①硫酸氢钠中滴加过量的偏铝酸钠,先生成硫酸铝,后硫酸铝和偏铝酸钠反应生成氢氧化铝;
②碳酸钠中加入等物质的量的硫酸氢钠,反应生成等物质的量的碳酸氢钠和硫酸钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性;
(5)铝做阳极失去电子,生成铝离子,和碳酸氢根双水解生成氢氧化铝和二氧化碳;氢氧化铝受热分解生成氧化铝和水.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S.元素C在同周期的主族元素中原子半径最大,则C处于IA族,元素B的原子最外层电子数是其电子层数的2倍,结合原子序数可知,B原子只能有2个电子层,最外层电子数为4,故B为碳元素,可推知C为Na;元素A的单质在常温下呈气态,则A为H元素.
(1)CA为NaH,和水反应生成氢氧化钠和氢气,反应方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(2)B为碳元素,符号为C,CA为NaH,电子式为: ,铝元素在周期表中的位置为:第三周期ⅢA族,
,铝元素在周期表中的位置为:第三周期ⅢA族,
故答案为:C; ;第三周期ⅢA族;
;第三周期ⅢA族;
(3)硫化氢的燃烧热表示为1摩尔硫化氢完全燃烧生成液态水和二氧化硫气体时放出aKJ的热量,热化学方程式为:H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g)△H=-aKJ/mol,
故答案为:H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g)△H=-aKJ/mol;
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,甲为碳酸钠,乙为偏铝酸钠,丙为硫酸氢钠.
①硫酸氢钠中滴加过量的偏铝酸钠,先生成硫酸铝,后硫酸铝和偏铝酸钠反应生成氢氧化铝,离子方程式为:4H++AlO2-=Al3++2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:4H++AlO2-=Al3++2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;
②碳酸钠中加入等物质的量的硫酸氢钠,反应生成等物质的量的碳酸氢钠和硫酸钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性,溶液中离子浓度顺序为:c(Na+)>c(SO42-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(SO42-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)>c(CO32-);
(5)铝做阳极失去电子,生成铝离子,和碳酸氢根双水解生成氢氧化铝和二氧化碳,阳极电极反应为:Al+3HCO3--3e-=Al(OH)3+3CO2↑;氢氧化铝受热分解生成氧化铝和水,反应方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al+3HCO3--3e-=Al(OH)3+3CO2↑;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查结构性质位置关系应用,题目比较综合,涉及电子式、热化学方程式、元素化合物性质、离子浓度大小比较、电解原理等,是对学生综合能力的考查,难度中等.

| A. | 未成熟苹果的果肉遇碘水会变蓝 | |
| B. | 与锌块相连或与电源正极相连,钢铁一定能被保护 | |
| C. | 纤维素和油脂均可发生水解,都属于天然高分子化合物 | |
| D. | 加酶洗衣粉可以很好的洗涤毛织品上的污渍 |
| A. | 3和9 | B. | 6和8 | C. | 13和17 | D. | 15和17 |
| A. | NA个Cl2在常温常压下体积约为22.4L | |
| B. | 在20℃、101kPa时,22.4L氢气中约含有2NA个氢原子 | |
| C. | 25℃、1.01×105Pa,48g SO2中含有的原子数为3NA | |
| D. | 22 g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
 .
.


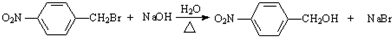 ;
;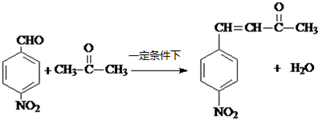 ;
;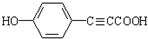 ;
;