题目内容
17.2.3g钠在干燥的空气中与O2反应,可得3.5g氧化物,据此可判断其产物为( )| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
分析 金属钠在干燥空气中被氧化后可能为氧化钠、过氧化钠或者二者的混合物,固体增重为氧元素质量,计算所得固体中Na、O原子的物质的量之比,进而判断产物组成.
解答 解:金属钠在干燥空气中被氧化后可能为氧化钠、过氧化钠或者二者的混合物,固体增重为氧元素质量,即3.5g固体中O原子质量为3.5g-2.3g=1.2g,则得到的固体中Na、O原子的物质的量之比为$\frac{2.3}{23}$:$\frac{1.2}{16}$=4:3>1:1,故产物为Na2O和Na2O2的混合物,
故选C.
点评 本题考查化学方程式计算,题目难度中等,注意利用所得固体中Na、O原子数目之比进行判断,也可以利用极限法进行解答,侧重考查学生分析能力及计算能力.

练习册系列答案
相关题目
3.一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )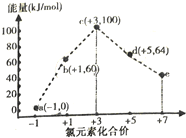

| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |
2.下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的是( )
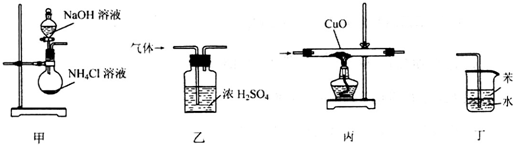

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气 |
9.下列关于反应H2(g)+I2(g)?2HI(g)的平衡常数K的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数是一个恒定量 | |
| B. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| C. | 从平衡常数K的大小不能推断一个反应进行的程度 | |
| D. | 平衡常数K只与温度有关,与反应物的浓度无关 |
6.下列关于某无色溶液所含离子检验的方法和结论正确的是( )
| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |

 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.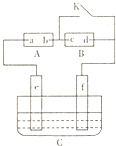 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为: