题目内容
9.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 密封保存的46 g NO2气体含有分子数小于NA | |
| B. | 标准状况下,22.4 LCCl4中含有的氯原子数目为4NA | |
| C. | 18gT2O(3H2O)中,含有的电子总数为10NA | |
| D. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L |
分析 A.二氧化氮会聚合为四氧化二氮;
B.标准状况下四氯化碳不是气体,标准状况下气体摩尔体积为22.4L/mol;
C.求出水的物质的量,然后根据水为10电子微粒来分析;
D.含NA个Na+的Na2O2钠离子物质的量为1mol,溶于1 L水中,溶液体积大于1L;
解答 解:A.46 g NO2气体物质的量=$\frac{46g}{46g/mol}$=1mol,二氧化氮会聚合为四氧化二氮,分子数小于NA,故A正确;
B.标准状况下四氯化碳不是气体,22.4 LCCl4中物质的量不是1mol,故B错误;
C.18gT2O的物质的量=$\frac{18g}{22g/mol}$=$\frac{9}{11}$mol,而水为10电子微粒,故$\frac{9}{11}$molT2O中含10mol×$\frac{9}{11}$×NA=$\frac{90}{11}$NA个,故C错误;
D.含NA个Na+的Na2O2钠离子物质的量为1mol,溶于1 L水中,溶液体积大于1L,Na+的物质的量浓度小于1 mol/L,故D错误;
故选A.
点评 本题考查了物质性质和结构、气体摩尔体积的条件应用,主要是物质的量和微粒数的计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
5.下列物质中属于混合物的是( )
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
14.下列分析中正确是( )
| A. | 含有碳元素的化合物不一定是烃 | |
| B. | 正丁烷分子中四个碳原子可能在同一直线上 | |
| C. | 常温常压下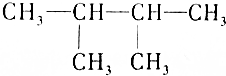 呈气态 呈气态 | |
| D. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 |
4.下列说法不正确的是( )
| A. | 二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| B. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| C. | 利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3 | |
| D. | 研究发现出土的青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能 |
14.某粒子用${\;}_Z^A{X^{n-}}$表示,下列关于该粒子的叙述错误的是( )
| A. | 质子数=A-n | B. | 中子数=A-Z | C. | 电子数=Z+n | D. | 所带电荷数=n |
1.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
19.如表为元素周期表的一部分.
回答下列问题:
(1)Z元素在周期表中的位置为第三周期VⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为-69℃和58℃.写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为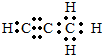 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol•L-1 NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期VⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为-69℃和58℃.写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为
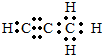 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol•L-1 NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
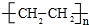 .
.