题目内容
11.1.92g铜投入一定量浓HNO3中,在一个密闭的真空容器中反应,铜完全溶解生成气体颜色越来越浅,共收集到672mL气体(标况).(1)反应生成的气体是NO2、NO;
(2)求这些气体的体积比.
分析 (1)铜投入一定量浓HNO3中,开始生成的是NO2,而随着硝酸的浓度逐渐变小,生成气体颜色越来越浅,故后来生成NO,据此分析;
(2)设混合气体中NO2的物质的量为xmol,NO的物质的量为ymol,根据得失电子数守恒和气体体积来计算.
解答 解:(1)铜投入一定量浓HNO3中,开始生成的是NO2,而随着硝酸的浓度逐渐变小,生成气体颜色越来越浅,故后来生成NO,故答案为:NO2、NO;
(2)设混合气体中NO2的物质的量为xmol,NO的物质的量为ymol,根据气体体积为672mL可知:x+y=$\frac{0.672L}{22.4L/mol}$ ①
根据得失电子数守恒可知:$\frac{1.92g}{64g/mol}×2$=xmol×1+ymol×3 ②
解①②可得:x=0.015mol,y=0.015mol
而在相同状态下,气体的体积之比等于物质的量之比,故NO2和NO的体积之比为1:1.
答:NO2和NO的体积之比为1:1.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列实验所采取的方法正确的是( )
| A. | 除去甲酸乙酯中甲酸和乙醇,加入饱和纯碱溶液,振荡静置后分液 | |
| B. | 除去蛋白质溶液中氨基酸,加Na0H溶液后分液 | |
| C. | 分离高级脂肪酸钠和甘油,加水后分液 | |
| D. | 除去甲苯中的苯酚,加入过量浓溴水后过滤 |
6.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
2.下列说法不正确的是( )
| A. | 氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路 |
9.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 密封保存的46 g NO2气体含有分子数小于NA | |
| B. | 标准状况下,22.4 LCCl4中含有的氯原子数目为4NA | |
| C. | 18gT2O(3H2O)中,含有的电子总数为10NA | |
| D. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L |
6.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的是Na,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式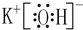 ;
;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物
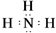 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式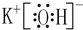 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程
 .
.