题目内容
1.下列有关溶液组成的描述合理的是( )| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
分析 A.无色溶液不含有色离子,离子之间不反应的能大量共存;
B.酸性溶液中不能大量存在和H+反应的离子;
C.碱性溶液中不能大量存在和OH-反应的离子;
D.离子之间不反应的能大量共存.
解答 解:A.这几种离子无色且不反应,所以能大量共存,故A正确;
B.酸性条件下ClO?、I?发生氧化还原反应而不能大量共存,故B错误;
C.OH?、HCO3?反应生成碳酸根离子和水而不能大量共存,故C错误;
D.中性条件下不能大量存在Fe3+,且Fe3+、I?发生氧化还原反应而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及复分解反应和氧化还原反应,易错选项是D,注意中性条件下Fe3+生成沉淀,题目难度不大.

练习册系列答案
相关题目
6.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
9.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 密封保存的46 g NO2气体含有分子数小于NA | |
| B. | 标准状况下,22.4 LCCl4中含有的氯原子数目为4NA | |
| C. | 18gT2O(3H2O)中,含有的电子总数为10NA | |
| D. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L |
16.以下叙述中错误的是( )
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
6.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的是Na,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物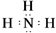 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式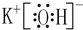 ;
;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物
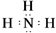 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式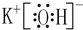 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程
 .
.
13.下列实验能获得成功的是( )
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
10.在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )
| A. | 都是轻金属 | B. | 都是活泼金属 | ||
| C. | 成本低廉 | D. | 这些金属的化合物熔点较低 |
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: