题目内容
10.用惰性电极电解下列物质的溶液,经过一段时间,溶液的物质的量浓度增大,pH不变的是( )| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
分析 电解时,根据溶液中离子放电顺序判断电解后溶液中氢离子浓度和氢氧根离子浓度的相对大小如何改变,如果电解后溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,如果氢氧根离子浓度大于氢离子浓度,溶液呈碱性,如果两者相等则溶液呈中性,据此回答.
解答 解:A、电解氯化钠,溶液中氢离子、氯离子放电,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,故A错误;
B、电解硝酸铜,溶液中铜离子和氢氧根离子放电,所以溶液中氢氧根离子浓度逐渐减小,pH值逐渐变小,故B错误;
C、电解硫酸,溶液中氢离子、氢氧根离子放电,所以溶液中水减小,溶液的物质的量浓度增大,pH减小,故C错误;
D、电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,所以溶液的pH值保持不变,故D正确;
故选:D.
点评 本题以电解原理为载体考查了电解质溶液中离子的放电顺序,电解电解质溶液时,有电解水型,如电解硫酸钠溶液;有电解电解质型,如电解氯化铜溶液;有电解电解质和水型,如电解氯化钠溶液.

练习册系列答案
相关题目
20.能正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 往水玻璃中通入少量二氧化碳:SiO32-+H2O+CO2═H2SiO3↓+CO32- |
18. 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
15.常温下,A溶液的PH=6,B溶液的[OH-]=10-10mol/L,C溶液的[H+]=10-1mol/L,三种溶液的酸性由强到弱的顺序是( )
| A. | ABC | B. | CBA | C. | BCA | D. | BAC |
20.NA表示阿伏伽德罗常数.下列说法正确的是( )
| A. | 18gNH4+含有质子的数目为10NA | |
| B. | 1molNa2O2与足量CO2反应时,转移电子的数目为2NA | |
| C. | 标准状况下,体积均为22.4L的O2、HCl、H2O含有的分子数目均为NA | |
| D. | 质量为16g的O2和O3的混合气体中所含氧原子的数目为NA |
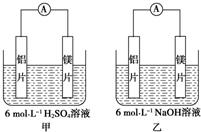 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.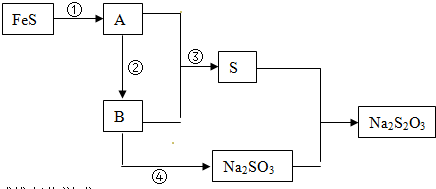
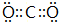 ,E的电子式
,E的电子式 ,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”)
,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”)