题目内容
15.常温下,A溶液的PH=6,B溶液的[OH-]=10-10mol/L,C溶液的[H+]=10-1mol/L,三种溶液的酸性由强到弱的顺序是( )| A. | ABC | B. | CBA | C. | BCA | D. | BAC |
分析 先根据题干数据分别计算出各溶液的pH值,溶液的pH值越大,其溶液的酸性越弱,据此判断三种溶液的酸性强弱.
解答 解:常温下,A溶液的pH=6,
B溶液中[OH-]=10-10mol/L,c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{10}}$mol/L=10-4mol/L,该溶液的pH=4;
C溶液中c(H+)=1×10-1mol/L,该溶液的pH=1;
溶液的pH值越大,其溶液的酸性越弱,所以三种溶液的酸性由强到弱的顺序是CBA,
故选B.
点评 本题考查了溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.某碱金属1.15g与足量水反应,得到标准状况下0.56L氢气,则该金属是( )
| A. | Li | B. | Na | C. | K | D. | Rb |
10.用惰性电极电解下列物质的溶液,经过一段时间,溶液的物质的量浓度增大,pH不变的是( )
| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
7.只用胶头滴管和试管,不用其他试剂无法鉴别的一组溶液是( )
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
4. 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
5.相同体积的某营养液两份,其配方如下表:
比较两份营养液中各种离子的浓度,下列有关说法正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
| (2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
| A. | 各种离子的浓度均相同 | B. | 只有c(K+)相同 | ||
| C. | 各种离子的浓度均不同 | D. | 只有c(Zn2+)相同 |
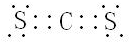 (用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;
(用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;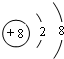 .
.