题目内容
18. 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
分析 由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,结合元素周期律及其单质化合物的性质来解答.
解答 解:由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,
A.非金属性S>Si>Al,非金属性越强,对应的最高价氧化物的酸性越强,故A错误;
B.SO2可使酸性高锰酸钾褪色,说明SO2具有还原性,漂白性无关,故B错误;
C.Cl原子未成键的孤对电子未画出,四氯化硅的电子式为 ,故C错误;
,故C错误;
D.X的气态氢化物为氨气,W的最高价氧化物对应水化物为硫酸,二者反应生成硫酸铵,属于离子化合物,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,W为推断的突破口,熟练掌握元素周期表与元素周期律,题目难度中等.

练习册系列答案
相关题目
9.下列物质属于电解质的是( )
| A. | NaCl溶液 | B. | SO3 | C. | HCl气体 | D. | Cu |
3.某碱金属1.15g与足量水反应,得到标准状况下0.56L氢气,则该金属是( )
| A. | Li | B. | Na | C. | K | D. | Rb |
10.用惰性电极电解下列物质的溶液,经过一段时间,溶液的物质的量浓度增大,pH不变的是( )
| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
7.只用胶头滴管和试管,不用其他试剂无法鉴别的一组溶液是( )
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
8.下列说法正确的是( )
| A. | 丙烷的比例模型是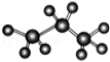 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 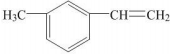 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为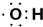 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
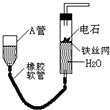 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题: