题目内容
2.已知:S+Na2SO3→Na2S2O3(硫代硫酸钠),为实现该反应,用FeS为原料,按下图流程制取: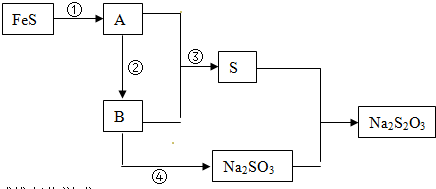
(1)试推断化学式:A:H2S B:SO2.
(2)写出以下过程中发生的化学方程式:
②2H2S+3O2=2SO2+2H2O.
③SO2+2H2S=3S+2H2O.
(3)写出以下过程中发生的离子方程式:
①FeS+2H+=Fe2++H2S↑.
④2OH-+SO2=SO32-+H2O.
分析 已知硫粉与亚硫酸钠共热可制得硫代硫酸钠Na2S2O3,转化关系可知A、B都含有硫元素,而且A+B→S,则该反应为SO2+2H2S=3S+2H2O,已知B→Na2SO3,则B为SO2,用FeS为原料反应生成A,判断是FeS和稀酸溶液反应生成H2S气体,所以A为H2S,据此分析回答问题,
(1)分析可知A为H2S,B为SO2;
(2)反应②是硫化氢燃烧生成二氧化硫和水,反应③是二氧化硫和硫化氢反应生成单质硫和水;
(3)反应①是FeS和酸反应生成硫化氢气体,反应④为二氧化硫与氢氧化钠反应生成Na2SO3.
解答 解:已知硫粉与亚硫酸钠共热可制得硫代硫酸钠Na2S2O3,转化关系可知A、B都含有硫元素,而且A+B→S,则该反应为SO2+2H2S=3S+2H2O,已知B→Na2SO3,则B为SO2,用FeS为原料反应生成A,判断是FeS和稀酸溶液反应生成H2S气体,所以A为H2S,
(1)物质A的化学式是H2S,物质B的化学式是SO2,
故答案为:H2S,SO2;
(2)反应②是硫化氢燃烧生成二氧化硫和水,2H2S+3O2=2SO2+2H2O,反应③是二氧化硫和硫化氢反应生成单质硫和水,反应的化学方程式为:SO2+2H2S=3S+2H2O,
故答案为:2H2S+3O2=2SO2+2H2O,SO2+2H2S=3S+2H2O;
(3)反应①是FeS和酸反应生成硫化氢气体,反应的离子方程式为:FeS+2H+=Fe2++H2S↑,反应④为二氧化硫与氢氧化钠反应生成Na2SO3,其反应离子方程式为:2OH-+SO2=SO32-+H2O,
故答案为:FeS+2H+=Fe2++H2S↑,2OH-+SO2=SO32-+H2O.
点评 本题考查了含硫化合物之间的相互转化知识,要特别注意题目所隐藏的已知信息,考查学生的综合分析能力,题目难度中等.

| A. | 合金具备金属的特性 | |
| B. | 合金的硬度一般比其组成成分金属的硬度大 | |
| C. | 合金的熔点一般比其组成成分的熔点低 | |
| D. | 合金只能由两种或两种以上的金属组成 |
| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
| A. | Na+ Cl- Mg2+ SO42- | B. | K+ Cu2+ I- SO42- | ||
| C. | NO3- K+ Cl- OH- | D. | Al3+ Na+ S2- Cl- |
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
| A. | CCl2F2 | B. | 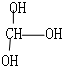 | C. | CH3CH2OH | D. | 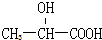 |
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. | 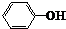 和 和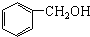 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 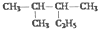 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
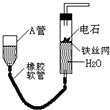 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题: